
【题目】下列说法不正确的是( )
A.乙烯分子中的 σ键和π键比例为 5:1
B.某元素气态基态原子的逐级电离能(kJmol﹣1)分别为 738、1451、7733、10540、13630、17995、21703, 当它与氯气反应时可能生成的阳离子是 X2+
C.Na、P、Cl 的电负性依次增大
D.向配合物[TiCl(H2O)5]Cl2H2O 溶液中加入足量的 AgNO3 溶液,所有 Cl-均被完全沉淀
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能________B(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为________(用元素符号表示)。
(2)D元素原子的价电子排布式是________。
(3)C元素的电子排布图为________________;E3+的离子符号为________________。
(4)F元素位于元素周期表的________区,其基态原子的电子排布式为________________。
(5)G元素可能的性质________。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一定条件下的化学平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.恒温恒容,充入H2,v(正)增大,平衡右移
B.恒温恒容,充入He,v(正)增大,平衡右移
C.加压,v(正),v(逆)不变,平衡不移动
D.升温,v(正)减小,v(逆)增大,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1的KMnO4溶液:Na+、Cl-、SO32-
B.使紫色石蕊试液显蓝色的溶液:K+、AlO2-、NO3-
C.0.1mol·L-1FeCl3溶液:NH4+、SCN-、SO42-
D.![]() =1×1012的溶液:Na+、SO42-、HCO3-
=1×1012的溶液:Na+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的浓度
Ⅰ.实验步骤
(1)配制待测白醋溶液,用________(填仪器名称)量取1.00mL食用白醋,在______(填仪器名称)中用水稀释后转移到100mL________(填仪器名称)中定容,摇匀即得待测白醋溶液
(2)量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数
(4)滴定,判断滴定终点的现象是__________达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3次。
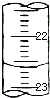
(5)如图是某次滴定时的滴定管中的液面,其读数为______ mL.
Ⅱ.实验记录
实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)甲同学在处理数据时计算得:c(市售白醋)=______mol·L-1
(7)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_____(填“偏小”“偏大”或“无影响”):观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的白醋浓度的测定值______(填“偏小”“偏大”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子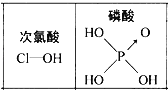
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 为主族元素,A、B、C 同周期且原子半径逐渐减小,A、B 原子的最外层电子数之和等于 C、D 原子的最外层电子数之和。A 元素基态原子的最外层电子排布为 nsnnpn,B 的氢化物可 与其最高价氧化物的水化物反应生成盐。D元素位于元素周期表中长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试 回答下列问题:
(1)C 元素基态原子的核外电子排布式是________。
(2)A、B 两元素各有多种氢化物,其电子总数为 10 的氢化物中沸点最高的是________(填化学式)。
(3)B 和 E 可形成离子化合物 BE5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
①该离子化合物的电子式为________。
②该离子化合物溶于水后溶液呈________性(填“酸”“碱”或“中”),其原因是________(用化学方程式表示) 。
(4)下列晶体结构示意图中(黑点表示阳离子,白点表示阴离子),能表示 C 与 D 形成的离子化合物结构的是________(填字母标号 a 或 b)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
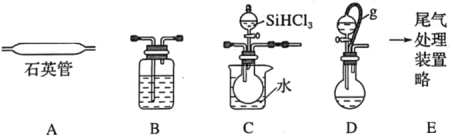
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为__。
(2)操作时应先打开装置__(选填“C”或“D”)中分液漏斗的旋塞,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中充分燃烧后,生成物B、C各为1.2mol。
(1)烃A的分子式为 ________。
(2)①若烃A不能因发生反应使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则烃A的结构简式为 __________。
②若烃A能使溴水褪色,在催化剂作用下可与H2加成,其加成产物分子中含有4个甲基,则所有符合条件的烃A的结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com