
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
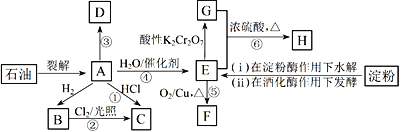
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
【答案】羟基 加聚反应 c CH2=CH2+H2O ![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
【解析】
A是植物生长调节剂,产量可以用来衡量一个国家的石油化工发展水平,则A应为CH2=CH2。CH2=CH2与H2加成生成B,则B是CH3CH3。CH2=CH2与HCl加成生成C,则C是CH3CH2Cl。D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”, D应为聚乙烯。CH2=CH2与H2O加成生成E,则E是CH3CH2OH。CH3CH2OH催化氧化生成F,则F是CH3CHO。CH3CH2OH被酸性K2Cr2O7氧化生成G,则G是CH3COOH。CH3CH2OH和CH3COOH在浓硫酸加热条件下生成H,则H是CH3COOCH2CH3。
(1)由分析可知,E是CH3CH2OH,则E的官能团名称为羟基。反应③是CH2=CH2发生加聚反应生成聚乙烯;
(2) a.聚乙烯、CH3CH3不能使溴水或酸性高锰酸钾溶液褪色,但CH2=CH2可以,故a错误;
b.CH3CH3的同系物中,当碳原子数≥4时开始出现同分异构现象,故b错误;
c.CH2=CH2和聚乙烯的最简式相同,则等质量的CH2=CH2和聚乙烯完全燃烧时消耗O2的量相等,生成CO2的量也相等,故c正确;
答案选c;
(3)反应④是CH2=CH2与H2O加成生成CH3CH2OH,化学方程式为CH2=CH2+H2O![]() CH3CH2OH。反应⑤是CH3CH2OH催化氧化生成CH3CHO,化学方程式为2CH3CH2OH+O2
CH3CH2OH。反应⑤是CH3CH2OH催化氧化生成CH3CHO,化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4) CH3CH2Cl是一种速效局部冷冻麻醉剂,可由反应①:CH2=CH2与HCl加成或②:CH3CH3与Cl2光照取代制备,反应①制备较好,理由是反应①为加成反应,无副反应发生,原子利用率高。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO及H2S都是有毒气体。下列有关这三种气体的说法正确的是 ( )
A. 都能与氧气反应 B. 都易溶于水
C. 都能与碱溶液反应 D. 都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 分子式为C8H8O2的芳香族化合物中属于羧酸的同分异构体有3种
B. 麦芽糖的水解产物有两种,且互为同分异构体
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同
D. 分子式为C4H8Cl2且含有两个甲基的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 ( )
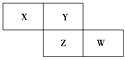
A. 原子半径:W>Z>XB. 非金属性:Z>Y
C. 最高化合价:X>ZD. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉在加热条件下的化学方程式为________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是:___→___→___→___。(填装置的编号)
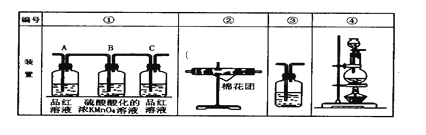
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______,C瓶溶液的作用是______。
(4)装置②中所加的固体药品是______,装置③中所盛溶液是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com