
【题目】某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含![]() 、
、![]() 及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(
及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(![]() ),其流程如下:
),其流程如下:
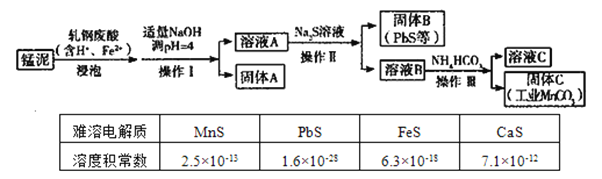
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ的名称是____。
(2)轧钢废酸中![]() 的作用是_________________。
的作用是_________________。
(3)固体A是_____________。(填化学式,下同)
(4)溶液B中含有____阳离子,通过表格中数据简单说明固体B与以上离子分离的原因_____。
(5)若固体C中不含![]() ,则溶液C中
,则溶液C中![]() __。(已知:
__。(已知:![]()
![]() )
)
【答案】过滤 将锰元素还原成![]()
![]()
![]() 、
、![]() 、
、![]() 、
、![]() PbS的溶度积常数远远小于MnS和CaS 500
PbS的溶度积常数远远小于MnS和CaS 500
【解析】
由锰泥成分为![]() 、
、![]() 及Pb、Ca等元素,轧钢废酸液主要成分为
及Pb、Ca等元素,轧钢废酸液主要成分为![]() +,两者发生氧化还原反应,生成了Mn2+和
+,两者发生氧化还原反应,生成了Mn2+和![]() ,再加NaOH调节pH=4,
,再加NaOH调节pH=4,![]() -=
-=![]() 过滤分离出固体A,溶液A中加入Na2S产生PbS,逆推知溶液B中含有Mn2+,根据Ksp(MnS)=2.5
过滤分离出固体A,溶液A中加入Na2S产生PbS,逆推知溶液B中含有Mn2+,根据Ksp(MnS)=2.5![]() -13、Ksp(CaS)=7.1
-13、Ksp(CaS)=7.1![]() -12,推知溶液B中还含有Ca2+。
-12,推知溶液B中还含有Ca2+。
(1)根据操作Ⅰ、操作Ⅱ、操作Ⅲ后的物质状态一个是固体,一个是液体,说明操作名称是过滤;答案:过滤。
(2)由锰泥![]() 、
、![]() ,化合价由+6、+4变为+2价,化合价降低发生了还原反应,轧钢废酸液主要成分为
,化合价由+6、+4变为+2价,化合价降低发生了还原反应,轧钢废酸液主要成分为![]() ,在H+作用下发生了氧化反应,所以
,在H+作用下发生了氧化反应,所以![]() 是还原剂,可将锰元素还原成
是还原剂,可将锰元素还原成![]() 。答案:将锰元素还原成
。答案:将锰元素还原成![]() 。
。
(3)由锰泥成分为含![]() 、
、![]() 及Pb、Ca等元素,轧钢废酸液主要成分为
及Pb、Ca等元素,轧钢废酸液主要成分为![]() +,两者发生氧化还原反应,生成了Mn2+和
+,两者发生氧化还原反应,生成了Mn2+和![]() ,同时还产生了Pb2+、Ca2+,再加NaOH调节pH=4,
,同时还产生了Pb2+、Ca2+,再加NaOH调节pH=4,![]() -=
-=![]() ,所以固体A是
,所以固体A是![]() ;答案:
;答案:![]() 。
。
(4)溶液A中加入Na2S产生PbS沉淀,硫化钠和硫化钾都是可溶的;逆推知溶液B中含有Mn2+,根据Ksp(MnS)=2.5![]() -13,Ksp(CaS)=7.1
-13,Ksp(CaS)=7.1![]() -12,推知溶液B中还含有Ca2+,所以B的溶液中含有的
-12,推知溶液B中还含有Ca2+,所以B的溶液中含有的![]() 、
、![]() 、
、![]() 、
、![]() ;因为Ksp(PbS)=1.6
;因为Ksp(PbS)=1.6![]() 10-28,比Ksp(MnS)=2.5
10-28,比Ksp(MnS)=2.5![]() -13,Ksp(CaS) =7.1
-13,Ksp(CaS) =7.1![]() -12小的多,所以PbS能沉淀出来。答案:
-12小的多,所以PbS能沉淀出来。答案:![]() 、
、![]() 、
、![]() 、
、![]() ;PbS的溶度积常数远远小于MnS和CaS。
;PbS的溶度积常数远远小于MnS和CaS。
5)由![]() ,当两者恰好沉淀时,
,当两者恰好沉淀时,![]() =
=![]() =500,若固体C中不含
=500,若固体C中不含![]() ,则溶液C中
,则溶液C中![]() 500;答案:500。
500;答案:500。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
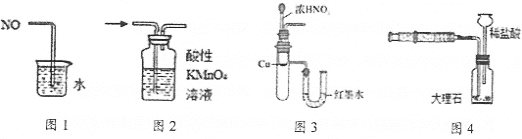
A.图1可用于吸收多余的NO
B.图2可用于检验SO2的漂白性
C.图3可用于说明铜与浓硝酸反应的能量变化
D.图4可用于测定CO2的生成速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格,回答有关问题:
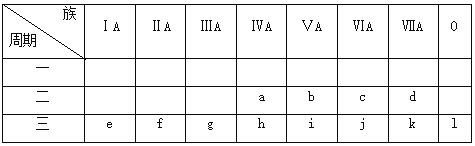
(1)上表中,第一电离能最小的元素是____(填元素名称,下同),电负性最大的元素是___
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是_____(填化学式,下同),碱性最强的是_____。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是_____(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)________。
(4)在e~k元素的原子中,原子半径最小的是_____(填元素符号),其价电子排布式为______;未成对电子数最多的是____(填元素符号),其最高价氧化物对应水化物的化学式为_____;有两个未成对电子的元素是________(填元素符号);M层有两个空轨道的是____(填元素符号),其阳离子结构示意图为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的固体 A 置于固定容积的密闭容器中发生分解反应,一段时间后达到平衡A(s) ![]() 2B(g)+C(g),以下可以作为平衡标志的是
2B(g)+C(g),以下可以作为平衡标志的是
A.2v正(B)=v逆(C)
B.气体 B 的体积分数不变
C.混合气体的平均摩尔质量不变
D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
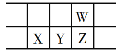
A.原子半径:W<X
B.Y单质是良好的半导体材料
C.气态氢化物热稳定性:W>Z
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应aA + bB![]() cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
A.写成2aA + 2bB![]() 2cC,Q值、K值均扩大了一倍
2cC,Q值、K值均扩大了一倍
B.写成2aA + 2bB![]() 2cC,Q值扩大了一倍,K值保持不变
2cC,Q值扩大了一倍,K值保持不变
C.写成cC![]() aA + bB,Q值、K值变为原来的相反数
aA + bB,Q值、K值变为原来的相反数
D.写成cC![]() aA + bB,Q值变为原来的相反数,K值变为倒数
aA + bB,Q值变为原来的相反数,K值变为倒数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
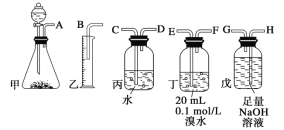
(1)电石制备的乙炔气体方程式______________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为_________________________;
(5)若没有除H2S的装置,测定结果将会____(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
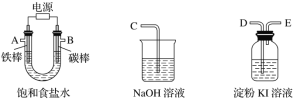
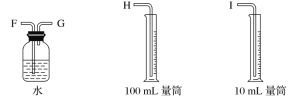
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com