
常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是( )
A.当V(NaOH)=20 mL时,溶液中离子浓度大小
关系:c(Na+)>c(HA-)> c(A2-) > c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2:1混合后,
其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A)
D.向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
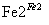 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有大量化学物质,是巨大的化学资源宝库,利用海水资源可以获取一系列化 工产品。
工产品。

(1)请写出电解饱和食盐水的化学方程式:  。
。
(2)在 电解饱和食盐水的装置中,阴极产生的气体为 。
电解饱和食盐水的装置中,阴极产生的气体为 。
为了降低能耗,充分利用氯碱工业产品进行联合生产的方法得 到推广应用。
到推广应用。
根据上图,请回答下列问题:
(3)X气体为 (填化学式)。
(4)写出图中燃料电池负极的电极反应: 。
(5)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少 量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。
量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。

已知将上述处理液加水稀释后,立即析出大量白色沉淀,请写出该反应的离子方程式: 。
(6)已知:①Mg(s)+Cl2(s) MgCl2(s) ΔH=-641 kJ·mol-1
MgCl2(s) ΔH=-641 kJ·mol-1
②Ti(s)+Cl2(g) TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:  ;该反应过程中还应控制的反应条件是 。
;该反应过程中还应控制的反应条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO 并没有产生CO2则反应的离子反应方程式为 。
并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
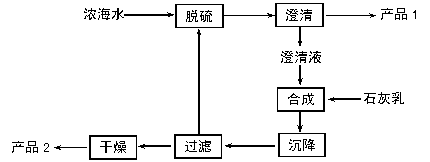 |
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_________,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别列表如下:
| 一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由表中数据可以推断,熔点为234℃的一溴代二甲苯的结构简式为______________;熔点为-54℃的二甲苯的名称为__________________________________。
(2)  的名称为______________。
的名称为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 1:3 B.2:3 C.3:2 D.3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com