
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 256.6kJ |
| 0.4mol |


科目:高中化学 来源: 题型:
| A、0.1 mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L |
| B、CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol水的摩尔质量是36g?mol-1 | ||
B、一个钠原子的实际质量约等于
| ||
| C、1.5mol O2的体积约为33.6L | ||
| D、将 100mL水加入到 100mL 1mol/L的NaOH溶液中,所得溶液为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
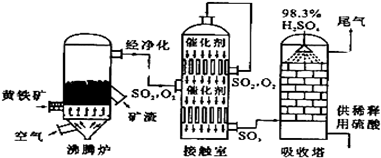
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下表中的部分短周期主族元素的相关信息.
阅读下表中的部分短周期主族元素的相关信息.| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素形成的简单离子中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ② |
| 操作A |
| ③ |
| 操作A |
| ④ |
| 操作A |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com