
| A. | 碳酸镁 | B. | 硫酸钡 | C. | 氢氧化镁 | D. | 碳酸钡 |
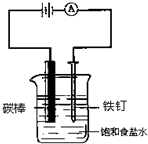
分析 电解池中,用石墨作电极电解,溶液中阳离子放电顺序为:K+<Ca2+<Na+<Mg2+<Al3+<H+<Zn2+<Fe2+<Sn2+<Pb2+<H+<Cu2+<Fe3+<Hg2+<Ag+;阴离子放电顺序为:S2->SO32->I->Br->Cl->OH->含氧酸根离子>F-,由图可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子Cl-放电,阴极上水电离出的氢离子放电,以此来解答.
解答 解:由图可知,碳与电源的正极相连,则为阳极,所以Fe为阴极,电解饱和食盐水,阳极上溶液中阴离子放电能力为Cl-大于OH-,阳极上氯离子失电子发生氧化反应,碳棒上发电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,阴极电极反应式为:2H2O+2e-=H2 ↑+2OH-,海水中含镁离子、钡离子、钠离子等金属离子,电解海水,电解一段时间后,结果很快在某一电极附近出现浑浊现象,Mg2++2OH-=Mg(OH)2↓为生成氢氧化镁沉淀,
故选C.
点评 本题考查电解食盐水,明确海水的成分、电解原理、离子的放电顺序、发生的电极反应即可解答,题目较简单.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
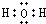 和
和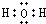 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
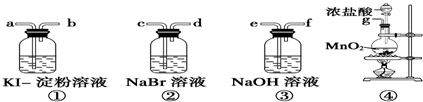
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
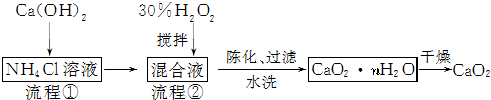

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
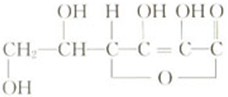 维生素C的结构式如下,
维生素C的结构式如下,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com