
分析 设出混合物中氧化亚铁、氧化铁的物质的量,然后分别根据氧元素守恒、铁元素守恒列式计算;根据计算结果可计算出混合物中FeO的物质的量分数;根据电子守恒可计算出Al的物质的量.
解答 解:设混合物中FeO、Fe2O3的物质的量分别为x、y,
根据O元素守恒可知:①x+3y=m,
根据铁元素质量守恒定律可知:②x+2y=n,
联立①②解得:x=(3n-2m)mol、y=(m-n)mol,
则混合物中FeO的物质的量分数为:$\frac{(3n-2m)mol}{(3n-2m)mol+(m-n)mol}$=$\frac{3n-2m}{2n-m}$;
根据电子守恒可知,mmol×(2-0)=n(Al)×3,解得:n(Al)=$\frac{2}{3}$n mol,
故答案为:$\frac{3n-2m}{2n-m}$;$\frac{2}{3}$n.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题

| A. | A的所有原子都在一个平面内 | B. | 反应①是加成反应 | ||
| C. | 反应②是消去反应 | D. | A的二取代产物只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICN不能和NaOH溶液作用 | |
| B. | ICN是一种离子化合物 | |
| C. | ICN可以和NaI作用生成单质碘 | |
| D. | ICN空气中受热也能发生题中所述分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
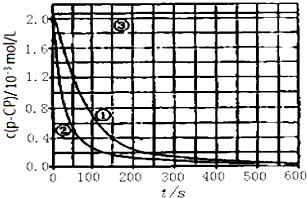
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色的KI溶液在存放过程中会变成黄褐色 | |
| B. | 该溶液中Fe3+、K+、Cl-、H+不能大量共存 | |
| C. | 向碘溶液中加入KI可增大碘的溶解度 | |
| D. | 0.2molKI与Cl2完全反应,消耗的Cl2为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s) $\stackrel{△}{→}$Na2CO3(s) | |
| B. | CuCl2$\stackrel{NaOH(aq)}{→}$ Cu(OH)2 $→_{△}^{葡萄糖}$Cu | |
| C. | Al $\stackrel{NaOH(aq)}{→}$ NaAlO2(aq) $\stackrel{△}{→}$ NaAlO2(s) | |
| D. | MgO(s)$\stackrel{HNO_{3}(aq)}{→}$ Mg(NO3)2(aq) $\stackrel{电解}{→}$ Mg(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5517.6kJ•mol-1 | |
| C. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com