
A、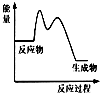 总反应为吸热反应 |
B、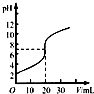 实验为用0.01 mol?L-1的HCl溶液滴定20 mL 0.01 mol?L-1的NaOH溶液 |
C、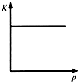 可以表示反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K随压强p变化的关系 |
D、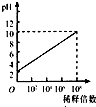 可以表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
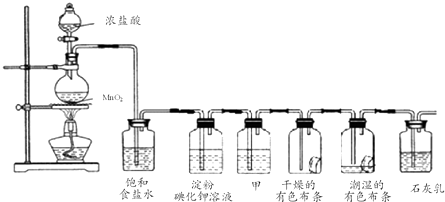
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为20的氯原子:
| ||
B、比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13种 | B、14种 |
| C、15种 | D、16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
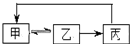 下表中各组物质之间不能通过一步反应实现下图转化的是( )
下表中各组物质之间不能通过一步反应实现下图转化的是( )| 甲 | 乙 | 丙 | |
| A | AlCl3 | Al(OH)3 | Al2O3 |
| B | SiO2 | H2SiO3 | Na2SiO3 |
| C | Cl2 | HCl | NaCl |
| D | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/LHF(弱酸) |
| B、0.5mol/L盐酸 |
| C、0.5mol/L.醋酸 |
| D、自来水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往NaHSO4溶液中滴加Ba(OH)2至溶液中性 SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
| C、NH4HCO3溶于少量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
| D、向NaClO溶液中通入少量的CO2:CO2+2ClO-+H2O=CO32-+2HClO( 已知Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com