
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(2019-nCOV)的感染,其结构如图所示。下列说法错误的是
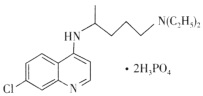
A.基态C1原子的核外电子有17种运动状态
B.C、N、O、P四种元素中电负性最大的是O
C.H3PO4分子中磷原子的价层电子对数为4
D.与足量H2发生加成反应后,该分子中手性碳原子个数不变
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请据图回答下列问题:

(1)图中A代表的元素是(用元素符号填写)_______________。图中X是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)Ⅴ在动物、植物细胞均含有,是生物体内理想的储能物质,则Ⅴ是_______________。
(3)物质P是_______________,其结构通式为______________________________;若Ⅳ分子由n个P分子(平均相对分子质量为m)组成的2条链组成,则该Ⅳ分子的相对分子质量大约为______________。从理论上分析,该Ⅳ物质至少有_____个氨基和_____个羧基。
(4)生物体中的Ⅱ、Ⅲ的基本组成单位是__________各单位间是通过______________键连接起来的,可以通过___________________________对细胞进行染色,染色后Ⅱ呈现出_______色,Ⅲ呈现出_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:

请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。

(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
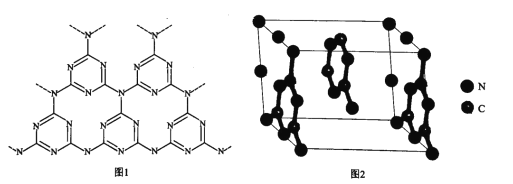
①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2LCHC13中含有的氯原子数目为1.5NA
B.10.0g质量分数为46%的乙醇溶液与足量钠反应产生的H2数目为0.05NA
C.常温常压下,124gP4中含σ键数目为4NA
D.向1L1mol·L-1NH4Cl溶液中加入氨水至中性,溶液中![]() 数目为NA
数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) ΔH=+1.9kJ/mol可知石墨比金刚石稳定
C.在101kPa时,2g H2完全燃烧生成液态水放出285.8 kJ热量,表示氢气燃烧热的热化学方程式为2H2(g)+O2(g) =2H2O(l) ΔH= -285.8 kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq) =H2O(l) ΔH= -57.3 kJ/mol,若将含1mol H2SO4 与含1mol Ba(OH)2的稀溶液混合,放出的热量等于114.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()
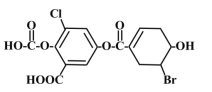
A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N![]() N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按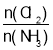 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
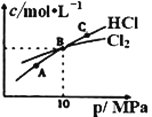
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com