
��1����֪2H2��g��+O2��g��=2H2O��l����H����571.6 kJ/mol��
CO��g����1/2O2��g����CO2��g����H����283.0 kJ/mol��ijH2 ��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6 gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ___________��
��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫���ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�Ӧʽ�ǣ�2CH3OH +3O2+4OH-=2CO32-+6H2O����ȼ�ϵ�ط�����Ӧʱ����������Һ��PH__________ (����� ����С�� ���䡱)�õ�صĸ�����ӦʽΪ_________________��
��3�� ������ȼ�ϵ�ؽ��д�ͭ�ľ�������ͭӦ���ӵ�Դ��________�����ô�ͭ�������ص�������ӦʽΪ_________________��
��1��1��1......2��
��2������.1�� CH3OH -6e����8OH- ��1����CO32-��6H2O ....2��
��3������..1�֡� Cu2+ + 2e- =Cu��.2��
��������
����������⣺ˮ�����ʵ���Ϊ=0.2mol����2H2+O2�T2H2O��֪��n��H2��=n��H2O��=0.2mol����2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1��֪��0.2molH2ȼ�շų�������Ϊ57.16KJ����COȼ�շų�������Ϊ113.74KJ-57.16KJ=56.58KJ������������CO�����ʵ���Ϊx����
CO��g��+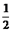 O2��g��=CO2��g����H=-283kJ•mol-1
O2��g��=CO2��g����H=-283kJ•mol-1
1 283KJ
X 56.58KJ
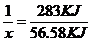
���x=0.2mol����n��CO��=0.20mol����ԭ���������H2��CO�����ʵ���֮��Ϊ1:1.��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ�������ӦΪ��3O2+12H2O+12e-=12OH-���ܷ�ӦʽΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O����ʽ�����������ӦΪ��2CH3OH-12e-+16OH-=2CO32-+12H2O����3���͵�Դ�����������ĵ缫����������ⷽ��������ͭ�����ص����������Ǵ�ͭ���缫��ӦΪ��Cu-2e-=Cu2+
���㣺�йط�Ӧ�ȵļ��㣻�ø�˹���ɽ����йط�Ӧ�ȵļ��� ��ѧ��Դ���͵��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�걱�������ƶ��и߶����£����л�ѧ�Ծ��������棩 ���ͣ������
 O2��g��=H2O��l����H=-285.8kJ/mol
O2��g��=H2O��l����H=-285.8kJ/mol O2��g��=H2O��g����H=-242kJ/molC��ʯī��+O2��g���TCO2��g����H=-394kJ/mol
O2��g��=H2O��g����H=-242kJ/molC��ʯī��+O2��g���TCO2��g����H=-394kJ/mol O2��g���TCO��g��H=-111kJ/mol��25��ʱһ����̼��ˮ��������ת���������Ͷ�����̼��Ӧ�ġ�H=______kJ/mol��
O2��g���TCO��g��H=-111kJ/mol��25��ʱһ����̼��ˮ��������ת���������Ͷ�����̼��Ӧ�ġ�H=______kJ/mol���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com