
����Ŀ���κ����ʵ�ˮ��Һ������ˮ�ĵ���ƽ�⣬����뷽��ʽ�ɱ�ʾΪ��![]() ���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶ȣ��棩 | 25 |
|
|
ˮ�����ӻ����� |
| a |
|
���������գ�
��1��25��ʱ����100mL��ˮ�м���0.01mol��![]() ���壬________��ѡ��ٽ��������ơ�����ˮ�ĵ���ƽ�⣬������Һ��________�ԣ�ѡ��ᡱ��������С�����ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ��________________________��
���壬________��ѡ��ٽ��������ơ�����ˮ�ĵ���ƽ�⣬������Һ��________�ԣ�ѡ��ᡱ��������С�����ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ��________________________��
��2����![]() ����a________
����a________![]() ��ѡ�
��ѡ�![]() ������
������![]() ����=������������____________��
����=������������____________��
��3��![]() ��ʱ����ô�ˮ��
��ʱ����ô�ˮ��![]() ����
����![]() ________mol/L�����¶���ij������Һ��
________mol/L�����¶���ij������Һ��![]() ������Һ��
������Һ��![]() ________mol/L��
________mol/L��
��4��![]() ��ʱ��0.01mol/L��NaOH��Һ��
��ʱ��0.01mol/L��NaOH��Һ��![]() ________��
________��
���𰸡��ٽ� �� ![]()
![]() ˮ�ĵ��������ȷ�Ӧ�����£�ƽ�������ƶ���
ˮ�ĵ��������ȷ�Ӧ�����£�ƽ�������ƶ���![]() ��
��![]() ������
������![]() ��
��![]() ����
���� ![]()
![]() 10
10
��������
��1���Ȼ��ˮ�������ԣ�
��2��ˮ�ĵ��������ȷ�Ӧ�������¶ȴٽ�ˮ���룬����ˮ�����ӻ���������
��3���ڵ���ƽ�⣬�������������Ũ�Ⱥ�����������Ũ����ͬ������ش�
��4������pH= -lgc(H+)�����㡣
��1��25��ʱ����100mL��ˮ�м���0.01mol��![]() ���壬�ٽ�ˮ�ĵ��룬笠�����ˮ�������ԣ���ˮ�ⷽ��ʽΪ��
���壬�ٽ�ˮ�ĵ��룬笠�����ˮ�������ԣ���ˮ�ⷽ��ʽΪ��![]() ��
��
��2��ˮ�ĵ���Ϊ���ȷ�Ӧ�������¶ȣ�ƽ����������Ӧ�����ƶ�������ˮ�����ӻ����������ݱ���֪���¶ȴ�С˳���ǣ�25��t1��t2����a��1��1014��
��3��ij�¶��´�ˮ�е�c(H+)=2.4��107mol/L�����ʱ��Һ�е�c(OH)=2.4��107mol/L�����¶���ˮ�����ӻ���Kw= c(H+)��c(OH)=2.4��107mol/L��2.4��107 mol/L=5.76��1014��ij������Һ��![]() ����������Ũ��Ϊ102mol/L�������Һ��c(OH)=
����������Ũ��Ϊ102mol/L�������Һ��c(OH)=![]() =
=![]() =5.76��1012 molL1��
=5.76��1012 molL1��
��4��0.01mol/L������������Һ���������ӵ�Ũ��c(OH)=102mol/L����c(H+)=![]() =10-10mol/L��pH= lgc(H+)= lg1010=10��
=10-10mol/L��pH= lgc(H+)= lg1010=10��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�ĵ缫��Ӧʽ
��Zn+H2SO4=ZnSO4+H2��
����_____________________������____________________��
�ڶ��Ե缫�������ͭ��Һ
����_____________________������____________________��
�ܵ�ⷽ��ʽ________________________���ܵ�����ӷ���ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t ��ʱAgCl��Ksp��4��10-10������˵������ȷ����

A. ��t ��ʱ��AgBr��KspΪ4.9��10-13
B. ͨ����������ʹ��Һ��a��䵽c��
C. ͼ��b����AgBr��������
D. ��t ��ʱ��AgCl(s)��Br-(aq) ![]() AgBr(s)��Cl-(aq)��ƽ�ⳣ��K��816
AgBr(s)��Cl-(aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ֱ��Ǽס�������ͬѧ����Ӧ��AsO43����2I����2H�� ![]() AsO33����I2��H2O����Ƴɵ�ԭ���װ�ã�����C1��C2��Ϊ̼����������ͼ���ձ�����μ�������Ũ���������ͼ��B�ձ�����μ�������40% NaOH��Һ��
AsO33����I2��H2O����Ƴɵ�ԭ���װ�ã�����C1��C2��Ϊ̼����������ͼ���ձ�����μ�������Ũ���������ͼ��B�ձ�����μ�������40% NaOH��Һ��
 ��
��
������������ȷ����
A. �������ʱ��������(A)ָ�뷢��ƫת
B. �������ʱ����Һ��ɫ��dz
C. �������ʱ��C2������
D. �������ʱ��C1�Ϸ����ĵ缫��ӦΪI2��2e��=2I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�����±���
���� | HCOOH | HCN | H2CO3 |
���볣��(25��) | Ka = 1��77��10 -4 | Ka=4.3��l0-10 | Ka1=5.0��l0-7 Ka2=5.6��l0-11 |
��0.1 moI/L NaCN��Һ��0.1mol/L NaHCO3��Һ�У�c��CN-��______c��HCO3 -��������>������<������=������
�ڳ����£�pH��ͬ��������Һ
A��HCOONa B��NaCN C��Na2CO3��
�����ʵ���Ũ���ɴ�С��˳����________�����ţ���
����֪25��ʱ��HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O��1�� ��H=-a kJ/mol
H+(aq) +OH-(aq) =H2O��1�� ��H=-b kJ/mol
���������Ȼ�ѧ����ʽΪ__________________________________��
�ܽ�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��______________________��
�������£�����Ũ�ȵ�HCOONa��ҺpH =9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����:
______________________________����Һ��![]() =___________��
=___________��
��2�������£���0.100 mol/L������Һ�ζ�20.00mL0.l00mol/L ��ij��ˮ��Һ���ζ�������ͼ��ʾ��

��d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ_______________��
��b����ʾ����Һ��c(NH3��H2O)-c(NH4+)=_____������Һ�е���������Ũ�ȱ�ʾ����
��pH =10�İ�ˮ��pH =4��NH4C1��Һ�У���ˮ�������c(H+)֮��Ϊ____��
��3����֪Ksp(BaCO3) =2.6��l0-9��Ksp( BaSO4)=1.1��10-10.
���ֽ�Ũ��Ϊ2��10-4mol/LNa2CO3��Һ��BaCl2��Һ�������ϣ�������BaCO3��������BaCl2��Һ����СŨ��Ϊ____mol/L��
������BaSO4�������Һ�еμ�Na2CO3��Һ������BaCO3��������ʱ����Һ��![]() =___________��������λ��Ч���֣���
=___________��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ظ�����(Na2Cr2O7)�ᾧ���ĸҺ(����������Fe3+)�����ظ���� (K2Cr2O7)���乤�����̼���������ܽ����������ͼ��ʾ��
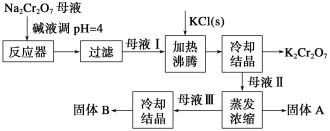

��1����Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ����_____________________��
��2��ͨ����ȴ�ᾧ��������K2Cr2O7��ԭ����________________________________��
��3������A����Ҫ�ɷ�Ϊ__________���ѧʽ��������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ___________(�I������)�У�������߲����ֿ�ʹ�ܺĽ��͡�
��4���ⶨ��Ʒ��K2Cr2O7�����ķ������£���ȡ��Ʒ����2.500 g ���250 mL��Һ������Һ��ȡ��25.00 mL�ڵ���ƿ�У�����10 mL 2 mol��L-l H2SO4��Һ������KI��Һ(���Ļ�ԭ����ΪCr3+)�������ڰ���5 min��Ȼ�����100 mL����ˮ��3 mL ����ָʾ������0.1200 mol��L-l Na2S2O3����Һ�ζ�(��֪I2+ 2S2O32-=2I-+S4O62-)��
��������Һ��KI ��K2Cr2O7��Ӧ�����ӷ���ʽΪ_____________________________��
����ʵ���й���ȥNa2S2O3����Һ40.00 mL�������ò�Ʒ���ظ���صĴ���Ϊ__________%( ����2 λС�����������������������ʲ����뷴Ӧ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֱ���Ϊ��ɫ���⣬���й��ں����˵����ȷ����( )
A.����Լռ����������71%B.��ˮ��Ԫ�ؽ�Ϊ����ʮ����
C.�����Ǻ�ˮ������Ψһ����D.��ˮ���и�ʴ�Զ�������ȴѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á�
(1)��̬Fe3+�ĵ����Ų�ʽΪ_________________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�档FeCl3�ľ���������________��FeSO4������������SO42-�����幹����__________��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȡ�1 mol Fe(CO)5�����к�________mol�Ҽ�����CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)��
(5)����������ľ���ṹʾ��ͼ��ͼ1��ʾ���þ�������������������֮��Ϊ_____��

(6)������������ľ�����ͼ2��ʾ����֪����������������ܶ�Ϊ��g��cm-3��NA���������ӵ�������ֵ���ڸþ����У���Fe3+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̺˼��Ϊ___________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ļ������24g��ַ�Ӧ�������ˮ18g����ԭ��������������������������ȿ����ǣ� ��
A.1��4B.1��11C.2��1D.1��8
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com