
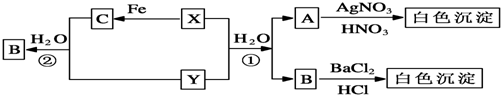
分析 A与硝酸银溶液、稀硝酸生成白色沉淀可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,结合对应物质的性质以及题目要求解答该题.
解答 解:A与硝酸银溶液、稀硝酸生成白色沉淀可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,
(1)由以上分析可知,Y为SO2,C为FeCl3,
故答案为:SO2;FeCl3;
(2)Y为SO2,Y物质的检验方法是将气体通入品红溶液,若品红褪色则说明有二氧化硫气体,
故答案为:将气体通入品红溶液,若品红褪色则说明有二氧化硫气体;
(3)X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=SO42-+4H+2Cl-,
故答案为:SO2+Cl2+2H2O=SO42-+4H+2Cl-;
(4)二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意本题推出A中含有Cl-、B中含有SO42-后逆推X、Y要联想X、Y应是含有Cl和S的有刺激性气味的气体,常见的为Cl2和SO2,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 红磷转化为白磷,属于物理变化 | |
| B. | 石墨导电、金刚石不导电,故二者不是同素异形体 | |
| C. | O2和O3分子式不同,结构相同 | |
| D. | 单质硫有S2、S4、S6等,它们都是硫的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )| A. | 原子半径大小顺序为r(Q)>r(R)>r(T)>r(M)>r(W) | |
| B. | Q、W的单核离子的核外电子数相等 | |
| C. | 五种元素均能形成氢化物 | |
| D. | W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,是最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
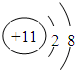 ;
;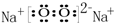 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 甲与丁形成的分子是酸性氧化物 | ||
| C. | 简单离子半径:丁>乙>丙 | D. | 甲与乙形成的化合物均有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯是一种油状物质,会浮在水面上 | |
| B. | 实验室制硝基苯需要用水浴加热,控制温度在50℃~60℃ | |
| C. | 硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒 | |
| D. | 硝基苯是由甲苯和硝酸直接反应生成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com