
| A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3 |
| B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
| D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)也是分子晶体 |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.该元素属于第七周期 | B.该元素位于ⅢA族 |
| C.该元素为金属元素,性质与82Pb相似 | D.该同位素原子含有114个电子,184个中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |  | 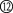 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一周期的非金属元素,由左到右其氧化物对应水化物的酸性依次递增 |
| B.aXn-与bYm+两种离子电子层结构相同,则b-a=n+m |
| C.同一主族非金属元素对应氢化物稳定性依次递增,是由于其相对分子质量依次递增、分子间作用力增强所导致的 |
| D.同一主族非金属元素对应氢化物沸点由上到下依次递增 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.密度逐渐减小,颜色逐渐加深 | B.氧化性逐渐加强 |
| C.还原性逐渐减弱 | D.与氢化合条件逐渐困难 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.必为第1层 | B.只能是第2层 |
| C.只能是第3层 | D.可以是任意层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s12s1 | B.1s22s12p1 |
| C.1s22s22p63s2 | D.1s22s22p63p1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com