��ҵ�ϳɰ����Ʊ�����ɲ�����ͼ1���̽�������������
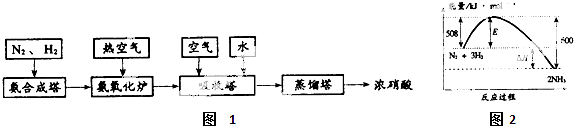
��1����ͼ2��ʾ��298Kʱ�����������ϳɰ���Ӧ�����е������仯�����ںϳɰ��ķ�Ӧ����˵����ȷ����
�����ţ���
a���÷�Ӧ�����������¶������Է�����
b�������������ʹ�÷�Ӧ��E�͡�H����С
c�����÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK
1��K
2����K
1��K
2d���÷�Ӧ�����˹��̵�
��2����800��ʱ�����������ڰ�����¯�з�Ӧ����Ҫ������NO��H
2O����ʵ�������а�����������������������{�����백�����ʵ����ȣ��Ԧ�[n��O
2��/n��NH
3��]��ʾ}�Ĺ�ϵ��ͼ3��ʾ��
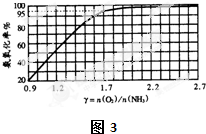
����ʵ�������У�����ֵά������ֵ
֮��Ϊ�ã�
��ʵ�������У�ͨ�백����¯���ǿ�������ʹ���������ʴﵽ95%��Ӧ���ư��ڰ����������������
���������ԼΪ_
��������ռ�������������Ϊ20%����
��3�����ڶ����������ܱ�ˮ��ȫ���գ�������ɵ������뾭��������������յ�ѭ��������ʹ����ת��Ϊ���ᣨ������������������е�������ʧ����
�ٴ������Ϸ�����Ҫʹ������ȫת��Ϊ���ᣬ��ԭ�ϰ������������ʵ�����Ͷ�ϱ�����Ϊ
��
������������ϵ�ԭ�ϱȽ�ԭ�Ϸ���һ�����з�Ӧ�������ܱ������н��У��������ʲ�����罻���������������Һ����������Ϊ
��
��ѭ�������Ĵ���������������������ת���ʾ���һ������ѧ��ϵ������һ�����Ķ������������ԼҪ����
��ѭ������������ʹ����������ת����ԼΪ96%��






 ����Ԫ�صĵ��ʼ��仯�����Ӧ�ý�Ϊ�㷺����ش��������⣺
����Ԫ�صĵ��ʼ��仯�����Ӧ�ý�Ϊ�㷺����ش��������⣺ �ù�����H2SO4��NaOH��NH3��H2O��NaCl����Һ��������ͼ��ʾ����ֿ��������ӣ�����Һ�١��ڡ��ۡ����ǣ�������
�ù�����H2SO4��NaOH��NH3��H2O��NaCl����Һ��������ͼ��ʾ����ֿ��������ӣ�����Һ�١��ڡ��ۡ����ǣ�������