
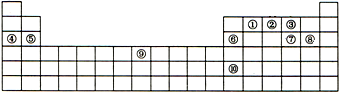
 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素.分析 据元素在周期表中的位置,可以确定各序号对应的元素,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为In,结合元素周期律和元素周期表的结构及部分元素的性质答题;
解答 解:据元素在周期表中的位置,可以确定各序号对应的元素,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为In,
(1)元素⑥的元素名称是铝,⑤为Mg,位于元素周期表的s区,
故答案为:铝;s;
(2)①为C,其价电子数是4,元素⑨为Fe,在元素周期表的第4周期第ⅤⅢ族,
故答案为:4;ⅤⅢ;
(3)根据元素周期律,同周期元素从左向右,元素非金属性逐渐增强,①为C,②为N,③为O,所以在元素①、②、③中,非金属元素最强的是O,离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以元素③、⑦、⑧的简单离子的半径由大到小的顺序为S2->Cl->O2-,
故答案为:O;S2->Cl->O2-;
(4)元素性质周期表变化的实质是元素原子核外电子排布的周期性变化,⑩为In元素,它与铝同主族,金属性强于铝,所以铟的单质可能具有的性质是能导电导热、能与稀盐酸反应生成氢气、其晶体属金属晶体,故选ab,
故答案为:核外电子排布;ab;
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是Al2O3,在元素①-⑩中,由于氧元素没有氧化物质的水化物,所以除了氧外,非金属性最强的是氯元素,所以①-⑩中最高价氧化物的水化物中,酸性最强的是HClO4,
故答案为:Al2O3;HClO4;
(6)⑨为Fe,铁原子的外围电子排布为3d64s2,
故答案为:3d64s2;
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com