
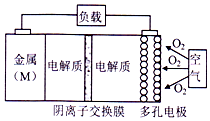
 电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )
电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )| A. | “金属(M)〜空气电池”放电过程的正极反应式:O2+2H2O+4e-=4M(OH)n | |
| B. | 比较Mg、Al、Zn三种“金属-空气电池”,“Al-空气电池”的理论比能量最高 | |
| C. | 电解质溶液中的阴离子从负极区移向正极区 | |
| D. | 在“M-空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
分析 A.正极上氧电解质溶液中的阴离子从负极区移向正极区气得电子和水反应生成OH-;
B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多;
C.电解质溶液中的阴离子从正极区移向负极区;
D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-.
解答 解:A.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为$\frac{1g}{24g/mol}$=$\frac{1}{12}$mol、$\frac{1g}{27g/mol}$×3=$\frac{1}{9}$mol、$\frac{1g}{65g/mol}$=$\frac{1}{32.5}$mol,所以Al-空气电池的理论比能量最高,故B正确;
C.电解质溶液中的阴离子从正极区移向负极区,而不是从负极区移向正极区,故C错误;
D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;
故选C.
点评 本题考查原电池原理,为高频考点,侧重考查学生分析判断、获取信息解答问题及计算能力,明确各个电极上发生的反应、离子交换膜作用、反应速率影响因素、氧化还原反应计算是解本题关键.


科目:高中化学 来源: 题型:选择题
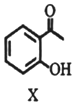 →
→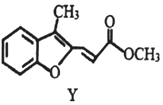 下列说法不正确的是( )
下列说法不正确的是( )| A. | 物质X的分子式为C8H8O2 | |
| B. | 物质X中所有碳原子可能在同一平面内 | |
| C. | 物质Y的1H核磁共振谱图中有8组特征峰 | |
| D. | 1molY最多可与6mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 7.8g过氧化钠与足量水反应,转移电子数为0.2NA | |
| C. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| D. | 100mL0.1mol/L的Na2SO4溶液中,所含离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Q3Y2与水可剧烈反应,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑
,Q3Y2与水可剧烈反应,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SiF4)消耗=4v(HF)生成 | B. | HF 的体积分数不再变化 | ||
| C. | 容器内气体压强不再变化 | D. | 容器内气体总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液与 Fe 的反应:Cu2++Fe═Cu+Fe3+ | |
| B. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| C. | 氢氧化铝溶液与盐酸的反应:OH-+H+=H2O | |
| D. | 水垢中的CaCO3用CH3COOH溶液除去:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 达平衡时,6v(H2)正=2 v(CO2)逆 | B. | 正反应的反应热:△H<0 | ||
| C. | 平衡常数:Kb<Kc | D. | 曲线I的投料:n(H2):n(CO2)=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 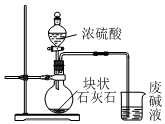 用装置甲制取CO2并通入废碱液 | |
| B. |  用装置乙从下口放出分液后上层的有机相 | |
| C. |  用装置丙分离水相中加入Ca(OH)2产生的CaCO3 | |
| D. |  用装置丁将滤液蒸发结晶得到NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
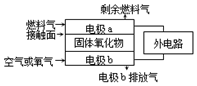 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示.下列关于固体燃料电池的有关说法中正确的是( )
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示.下列关于固体燃料电池的有关说法中正确的是( )| A. | 固体氧化物的作用是让电子在电池内通过 | |
| B. | 固体氧化物中O2-从a极向b极移动 | |
| C. | 电极b为电池的负极,电极反应式为:O2+4e-=2O2- | |
| D. | 若以C3H8为燃料气,则接触面上发生的反应为C3H8-20e-+10O2-═3CO2+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com