

 .
.分析 (1)元素周期表1-20号元素中Si可作半导体材料,二氧化硅可用作光导纤维材料,高锟被称为光纤之父;
(2)离子化合物AB2的电子总数为32,能与食盐水反应,一般为碳化钙与水的反应,生成乙炔;
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,则甲是C元素,乙元素的p亚层上有3个电子,则乙是N元素.
①甲是C元素,其原子核外有6个电子,根据构造原理书写其基态原子核外电子排布式;
②原子晶体的硬度较大,根据元素形成的化合价确定其化学式.
解答 解:(1)元素周期表1-20号元素中属于非金属元素但又具有一定的金属性,为Si元素,Si单质可作半导体材料,二氧化硅可用作光导纤维材料,高锟被称为光纤之父,故答案为:硅;SiO2;高锟;
(2)离子化合物AB2的电子总数为32,能与食盐水反应,一般为碳化钙与水的反应,生成乙炔,反应的方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,则甲是C元素,乙元素的p亚层上有3个电子,则乙是N元素.
①甲是C元素,其原子核外有6个电子,C原子最外层4个电子,为2s22p2,两个电子分别占据2个p轨道,自旋反向相同,第一个电子层为1s2,其电子轨道表达式为:
 ,
,
故答案为:
 ;
;
②金刚石为原子晶体,硬度较大,碳和氮形成的化合物硬度较大,所以属于原子晶体,
故答案为:原子;
点评 本题考查较综合,涉及元素周期表、晶体类型以及轨道表达式的确定等知识点,为高频考点,侧重于学生的分析能力的考查,注意把握原子结构以及元素周期表等知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: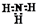 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>W>Z | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:Z3->W->Y+>X2+ | D. | 原子的最外层电子数目:X>Y>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸:HNO3、H2SO4、NaHSO4、NaHCO3 | B. | 碱性氧化物:K2O、Na2O、CaO、MgO | ||
| C. | 胶体:牛奶、豆浆、碘酒、石灰水 | D. | 电解质:MgCl2、Na2CO3、C2H5OH、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com