

| ||
| ||


科目:高中化学 来源: 题型:
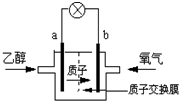 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )| A、b极为电池的负极 |
| B、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生12NAq库仑的电量 |
| C、电池工作时电流由a极沿导线经灯泡再到b极 |
| D、电池正极的电极反应为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| C、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1则水电离的热化学方程式为:H2O(l)?H+(aq)+OH-(aq)△H=+57.3 kJ?mol-1 |
| D、生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X元素的次外层上有18个电子 |
| B、Y元素的最外层上有2个电子 |
| C、Z元素形成的单核阳离子,具有稀有气体元素的核外电子排布 |
| D、R元素形成的单核阴离子,具有稀有气体元素的核外电子排布 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com