

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
分析 Ⅰ、(1)将矿石中的二氧化硅转变为炉渣,方程式为CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$ CaSiO3;
(2)高炉中铁矿石(以磁铁矿为例)被还原剂CO还原成单质铁,结合原子守恒配平化学方程式;
Ⅱ、过量废铁屑加入硫酸溶液中溶解,加入碳酸氢钠溶液搅拌过滤得到硫酸亚铁溶液和滤渣氢氧化铝,滤液中加入稀硫酸和亚硝酸钠氧化亚铁离子为铁离子,减压蒸发过滤得到碱式硫酸铁;
(3)Fe为活泼金属,可与酸反应;
(4)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;
(5)所消耗氧气得到的电子的物质的量相当于NaNO2得到电子的物质的量;
(6)根据反应物和生成物判断离子方程式;
Ⅲ、阳极发生氧化反应,结合反应的方程式判断,电解池中电极商电子守恒,依据电子转移减少电解饱和氯化钠溶液中阴极电解反应中减小的氢离子物质的量,氢离子减小和溶液在亲一个离子增加物质的量相同,得到溶液中氢氧根离子浓度,结合离子积减少氢离子浓度得到溶液pH.
解答 解:Ⅰ、(1)将矿石中的二氧化硅转变为炉渣,方程式为CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$ CaSiO3,故答案为:将矿石中的二氧化硅等转变为炉渣;
(2)高炉中铁矿石(以磁铁矿为例)被还原剂CO还原成单质铁,结合原子守恒配平化学方程式为:Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2,故答案为:Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2;
Ⅱ、(3)Fe为活泼金属,可与酸反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
(4)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在[4.4~7.5)之间,故答案为:[4.4~7.5);
(5)n(O2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,则得到电子0.125mol×4=0.5mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则m(NaNO2)=0.5mol×69g/mol=34.5g,故答案为:34.5;
(6)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;
Ⅲ、阳极发生氧化反应,由总反应式FePO4+Li $\frac{\underline{\;\;△\;\;}}{\;}$LiFePO4可知,LiFePO4被氧化生成FePO4,反应的电极方程式为LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,n(Li)=$\frac{0.35g}{7g/mol}$=0.05mol,反应中电子转移0.05mol,电解食盐水,阴极电极反应为2H++2e-=H2↑,溶液中氢离子减小0.05mol,溶液中增加氢氧根离子物质的量为0..05mol,c(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,溶液的pH值为13,
故答案为:LiFePO4-e-═FePO4+Li+;13.
点评 本题考查制备原理的设计,题目难度中等,注意根据物质的性质和题给信息判断可能发生的反应,方程式的书写为解答该题的难点,也是易错点,注意体会书写方法.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 114号元素原子的中子数为175 | |
| B. | 114号元素原子的中子数为403 | |
| C. | 科学家宣布自己的研究成果错误是可耻的 | |
| D. | 科学研究成果是不可能有错误的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )
磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )| A. | 该物质的分子式为C8H9O6NP | |
| B. | 该物质能与金属钠反应,能发生银镜反应,还能使石蕊试液变红 | |
| C. | 作为芳香族化合物,该物质可能具有芳香气味 | |
| D. | 1mol该酯与NaOH溶液反应,最多消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
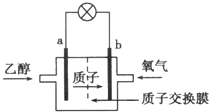 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com