
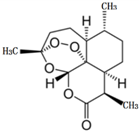
 2015年10月,中国女药学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献,与另外两位科学家共享2015年度诺贝尔生理学或医学奖.这是中国生物医学界迄今为止获得的世界级最高级大奖.青蒿素的键线式化学结构如图所示,下列说法不正确的是( )
2015年10月,中国女药学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献,与另外两位科学家共享2015年度诺贝尔生理学或医学奖.这是中国生物医学界迄今为止获得的世界级最高级大奖.青蒿素的键线式化学结构如图所示,下列说法不正确的是( )| A. | 青蒿素属于芳香化合物,能与H2发生加成反应 | |
| B. | 青蒿素能与氢氧化钠溶液发生反应 | |
| C. | 青蒿素的化学式为C15H22O5 | |
| D. | 青蒿素的核磁共振谱图中有12个峰 |
科目:高中化学 来源: 题型:选择题
| A. | 整个溶液变蓝色 | B. | 上层无色下层紫红色 | ||
| C. | 整个溶液显紫红色 | D. | 上层紫红色下层无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和丙烯 | B. | 甲烷和丁烯 | C. | 乙烷和乙烯 | D. | 丙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因亚硝酸钠有剧毒,所以不能用作食品添加剂 | |
| B. | 可用淀粉-KI试纸来鉴别一种盐溶液是亚硝酸钠还是氯化钠 | |
| C. | 能用硝酸银溶液来区别亚硝酸钠与氯化钠 | |
| D. | 因NaNO2具有较强的氧化性,可用酸性KMnO4溶液和FeCl2溶液鉴别NaCl与NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2分解过程中,溶液的pH逐渐下降 | |
| B. | Fe3+是该反应的催化剂 | |
| C. | 2H2O(l)+O2(g)=2H2O2(aq)在一定条件下能够自发进行 | |
| D. | v(H2O2)=2v(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 用K37ClO3与浓盐酸反应制氯气:K37ClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$K37Cl+3Cl2+3H2O | |
| C. | 足量小苏打溶液与氢氧化钡溶液混合:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 向AlCl溶液中滴加过量的氨水:Al3++4OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
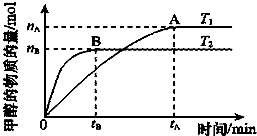 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com