
【题目】下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
【答案】C
【解析】
根据VSEPR理论和杂化轨道理论判断分子或离子的空间构型和键角。
①BCl3,根据VSEPR理论,配位原子个数为BP=3,孤电子对数为LP=![]() =0,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,中心B原子为sp2杂化,键角为120°;
=0,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,中心B原子为sp2杂化,键角为120°;
②NH3,根据VSEPR理论,配位原子个数为BP=3,孤电子对数为LP=![]() =1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心N原子为sp3杂化,理论上正四面体构型键角为109°28′,由于NH3分子中孤电子对存在,孤电子对斥力大于键合电子对斥力,使键角<109°28′;
=1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心N原子为sp3杂化,理论上正四面体构型键角为109°28′,由于NH3分子中孤电子对存在,孤电子对斥力大于键合电子对斥力,使键角<109°28′;
③H2O,根据VSEPR理论,配位原子个数为BP=2,孤电子对数为LP=![]() =2,则价电子对数为VP=BP+LP=2+2=4,根据杂化轨道理论,中心O原子为sp3杂化,理论上正四面体构型键角为109°28′,由于H2O分子中存在两对孤电子对,且孤电子对斥力大于键合电子对斥力,且存在两对孤电子对,使得键角比NH3分子的键角还小;
=2,则价电子对数为VP=BP+LP=2+2=4,根据杂化轨道理论,中心O原子为sp3杂化,理论上正四面体构型键角为109°28′,由于H2O分子中存在两对孤电子对,且孤电子对斥力大于键合电子对斥力,且存在两对孤电子对,使得键角比NH3分子的键角还小;
④PCl4+,根据VSEPR理论,配位原子数为BP=4,孤电子对数为LP=![]() =0,则价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,中心P原子为sp3杂化,键角为109°28′;
=0,则价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,中心P原子为sp3杂化,键角为109°28′;
⑤HgCl2,根据VSEPR理论,配位原子数为BP=2,孤电子对数为LP=![]() =0,则价电子对数为VP=BP+LP=2+0=2,根据杂化轨道理论,中心Hg原子为sp杂化,键角为180°;
=0,则价电子对数为VP=BP+LP=2+0=2,根据杂化轨道理论,中心Hg原子为sp杂化,键角为180°;
综上,键角由大到小的顺序为⑤①④②③,答案选C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
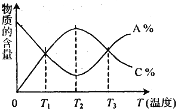
A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是___________ ,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接_____、 ____接______;B接______、_____接______ 。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为_________________。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8 mL(标准状况)。此时溶液OH- 浓度为___________。
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为2.24L(标准状况),且反应完全,则理论上电解池产生的为Cl2 的物质的量为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的n/m倍
C. 增加X的物质的量,Y的转化率降低
D. 降低温度,混合气体的平均相对分子质量变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用3.0g乙酸和4.6g乙醇反应,若实际产率是理论产率的67%,则可得到的乙酸乙酯的质量为:
A. 2.95gB. 4.4gC. 7.48gD. 8.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJmol﹣1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_____________.
(2)M是_____(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_____。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有__ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为________________。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为____________________gcm﹣3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有__________。
(5)科学家通过X﹣射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸溶液中c(H+)=0.1 mol·L-1,则该溶液的物质的量浓度( )
A.一定等于0.1 mol·L-1B.一定大于0.1 mol·L-1
C.一定小于0.1 mol·L-1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
B. 甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= —890.3kJ·mol-1
C. 原电池中发生的反应达到平衡时,该电池仍有电流产生
D. 500 mL 2.0 mol·L-1的HCl(aq)和500 mL 2.0 mol·L-1的NaOH(aq)反应,产生的热量等于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com