
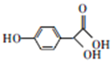
| A. | 用钠可检验M分子中存在羟基 | B. | M能发生酯化、加成、氧化反应 | ||
| C. | M的分子式为C8H8O4 | D. | M的苯环上一硝基代物有2种 |
分析 有机物含有酚羟基,可发生取代、氧化和颜色反应,含有羧基,具有酸性,可发生中和、酯化反应,含有醇羟基,可发生取代、氧化反应,以此解答该题.
解答 解:A.分子中含有酚羟基、醇羟基以及羧基,都可与钠反应生成氢气,不能用钠检验羟基,故A错误;
B.含有羟基,可发生酯化、氧化反应,含有苯环,可发生加成反应,故B正确;
C.由结构简式可知M的分子式为C8H8O4,故C正确;
D.苯环取代基位于对位位置,则有2种H原子,一硝基取代物有2种,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高频常见题型,侧重于学生的分析能力的考查,注意把握有机物官能团的性质,为解答该类题目的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 生成 SO3 为 2 mol | |
| B. | SO2 和 SO3 物质的量之和一定为 3 mol | |
| C. | 1molO2 恰好反应完 | |
| D. | SO2 的物质的量和 SO3 物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3溶液的电离:HCO3-+H2O?H2 CO3+OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式:2H2O+O2+4e-=4OH- | |
| D. | 以石墨作电极,电解硫酸铜溶液,发生氧化反应的电极反应式:Cu-2e-=Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com