
| A. | 卤素单质Cl2、Br2、I2的氧化性 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
分析 A.非金属性越强,单质的氧化性越强;
B.非金属性越强,氢化物越稳定;
C.金属性越强,单质与水反应更剧烈;
D.金属性强弱与失去电子数目多少无关,与难易程度有关.
解答 解:A.非金属性越强,单质的氧化性越强;故卤素单质Cl2、Br2、I2的氧化性强弱可以说明非金属性强弱,故A正确;
B.非金属性越强,氢化物越稳定,气态氢化物NH3、H2O、HF的稳定性以说明非金属性强弱,故B正确;
C.金属单质与水反应越剧烈,则金属性越强,故C正确;
D.金属性强弱与失去电子数目多少无关,与难易程度有关,也可以根据与酸反应的剧烈程度判断,故D错误,
故选D.
点评 本题考查金属性、非金属性强弱比较,难度不大,注意理解掌握金属性、非金属性强弱比较的实验事实.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
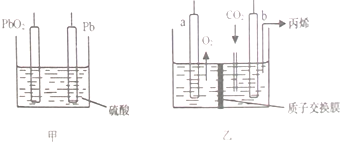
| A. | 为实现工作原理,PbO2电极应与b电极相连 | |
| B. | b电极反应式为:3CO2+18e-+18H+=6H2O+CH3CH=CH2 | |
| C. | 在铅蓄电池供电过程中,Pb电极质量不断减小 | |
| D. | 乙装置中H+由b电极向a电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
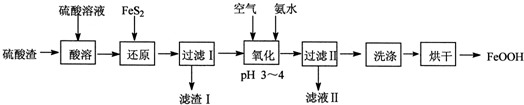
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 由反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,可得出C的非金属性强于Si | |
| D. | pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,使其充分反应,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、胶头滴管、温度计等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
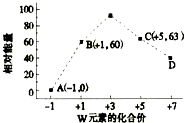 已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、锥形瓶、试管、温度计 | 探究温度对H2SO4和Na2S2O3反应速率的影响 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、电子天平 | 用固体氯化钠配制100mL0.5mol•L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com