
【题目】欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000 mol·L-1HCl 标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:

(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为2.10 mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为________ mL。
(2)乙学生做了2组平行实验,数据记录如下:
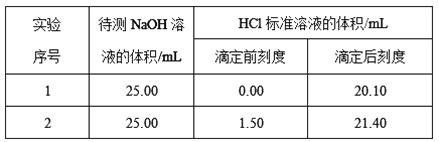
据此计算出待测NaOH溶液的物质的量浓度为____ mol·L-1(小数点后保留四位)。
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制取氨气。

(1)试管中发生反应的化学方程式是______________________________。
(2)干燥管中盛放的干燥剂是______________________________(填名称)。
(3)实验室中碳酸氢铵加热分解也可以制备氨气,该反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高铁酸钠(Na2FeO4)是一种绿色消毒净水剂,只在碱性环境中稳定存在。下列是通过次氧酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
I.制备高铁酸钠(Na2FeO4)
(1)制备NaClO溶液
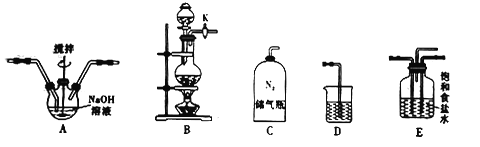
已知:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
①如何检查装置B的气密性?____________________________________________。
②实验室制取Cl2的化学方程式是_______________________,利用如图所给的装置组装成制备NaClO的正确连接顺序是![]() ________(填字母),其中装置E的作用是________(填序号)。
________(填字母),其中装置E的作用是________(填序号)。
a.混合气体 b.除去氯气中的氯化氢 c.干燥气体 d.观察气体的通入速率
③为了防止产生NaClO3,除搅拌和混入N2稀释外,还应采取的操作是__________________。
(2)制备Na2FeO4:将Fe(NO3)2溶液加入到NaOH与NaClO的混合溶液中,其反应的离子方程式是___________________________________。
II.高铁酸钠(Na2FeO4)具有强氧化性,某实验小组的同学对于高铁酸钠消毒后铁元素的存在形式展开如下探究:
【提出猜想】:猜想1:全部为Fe2+ 猜想2:全部为Fe3+ 猜想3: Fe2+和Fe3+都有
【设计实验】:
(1)证明溶液中只含有Fe2+的实验操作是_________________________________。
(2)某实验小组将消毒后的溶液分在两支试管中,进行如下实验:
步骤一:向试管1中加入K3[Fe(CN)6]溶液,现象是__________,所以溶液中不存在Fe2+;
步骤二:向试管2中滴入KSCN溶液,溶液变成血红色,所以溶液中存在Fe3+。
【实验结论】:高铁酸钠消毒后溶液中只存在Fe3+。
(3)小明同学认为上述实验结论不够严谨,原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是

A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列说法正确的是
A. 阻燃剂Al(OH)3受热分解时放出能量
B. 蚕丝、涤纶、棉花的主要成分均为蛋白质
C. 油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败
D. 硅太阳能电池与铜锌原电池工作时均由化学能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列物质进行分类:
①![]() H与
H与![]() H ②O2与O3 ③乙醇(C2H5OH) 与甲醚 (CH3—O—CH3) ④正丁烷与异丁烷 ⑤C60与金刚石;互为同分异构体的是__________________;
H ②O2与O3 ③乙醇(C2H5OH) 与甲醚 (CH3—O—CH3) ④正丁烷与异丁烷 ⑤C60与金刚石;互为同分异构体的是__________________;
(2)若将反应Fe+H2SO4===FeSO4+H2↑设计成原电池铜为原电池某一极材料,则铜为______(填“正”或“负”)极。该极上发生的电极反应为_____________________,外电路中电子由______极(填“正”或“负”,下同)向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备金属氯化物时,常用两种方法:①金属与氯气直接化合制得;②金属与盐酸反应制得,用以上两种方法都可制得的氯化物是
A. AlCl3 B. FeCl3 C. FeCl2 D. CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A. Cl2>Fe3+>I2 B. I2>Cl2>Fe3+
C. Fe3+>Cl2>I2 D. Cl2>I2>Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com