
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
答案 D
解析 短周期元素X、Z形成的最低价离子为X2-、Z-,Y+和Z-具有相同的电子层结构,则X、Y、Z三种元素分别处于第ⅥA、ⅠA、ⅦA族。又知X和Y处于同一周期,Y+和Z-具有相同的电子层结构,从而推知X、Y、Z分别为S、Na和F。A项,原子最外层电子数:F>S>Na;B项,Na单质为金属晶体,S、F2为分子晶体,S为固体,F2为气体,显然沸点Na>S>F2;C项,具有相同电子层结构的离子,元素的原子序数越大,原子半径越小,Na+、F-具有相同的电子层结构,则离子半径:F->Na+,S2-多一个电子层,所以S2-半径最大;D项,三种元素的原子序数关系为S>Na>F。


科目:高中化学 来源: 题型:
根据反应:2H2S+O2=2H2O+S、4NaI+O2+2H2SO4=2Na2SO4+2I2+2H2O、Na2S+I2=2NaI+S,下列物质氧化性强弱的判断正确的是( )
|
| A. | O2>I2>S | B. | H2S>NaI>H2O | C. | S>I2>O2 | D. | H2O>NaI>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯、溴和溴苯的物理性质如下表所示
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm﹣3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
如图为苯和溴取代反应的改进实验装置.其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑.
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式): .
(2)试管C中苯的作用是 ;反应开始后,观察D试管,看到的现象为
(3)在上述整套装置中,具有防倒吸作用的仪器有 (填字母).
(4)反应完毕后,将a瓶中的液体取出,经过 (填分离操作的名称)可获得获得粗溴苯.

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子结构及微粒间的数量关系的说法不正确的是(双选)( )
A.同种元素的原子均有相同的质子数和中子数
B.微粒+、Mg2+、O2-具有相同的电子层结构
C.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
D.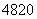 Ca2+的中子数比核外电子数多8
Ca2+的中子数比核外电子数多8
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表短周期的一部分,下列说法中正确的是( )
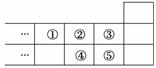
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物的酸性:⑤>④
D.元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_____________________________________________。
(2)[2013·广东理综,32(3)]完成煅烧过程中一个反应的化学方程式:________CuO+________Al2O3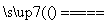 ________CuAlO2+________↑。
________CuAlO2+________↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO 、SO
、SO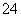 、Cl-、I-、HCO
、Cl-、I-、HCO ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是________;溶液中肯定不存在的离子是____________________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)_________________________ _______________________________________________。
(3)写出实验⑤中所有反应的离子方程式: ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:__________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO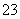 )∶n(HSO
)∶n(HSO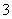 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 1∶91 |
| pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显________性,用化学平衡原理解释:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com