
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
分析 A.含有金属元素的化合物不一定是离子化合物,可能是共价化合物;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
D.多种非金属元素之间形成的共价键可能含有非极性键.
解答 解:A.含有金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故A错误;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物,如KOH,故B错误;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,所以含有离子键的化合物一定是离子化合物,故C正确;
D.多种非金属元素之间形成的共价键可能含有非极性键,如氨基酸中含有C-C非极性键,故D错误;
故选C.
点评 本题考查化合物和化学键的关系,明确物质的构成微粒及微粒之间作用力即可解答,采用举例法分析判断即可,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
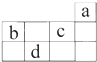
| A. | a原子的最外电子层上有8个电子 | |
| B. | c的最高价氧化物对应水化物为强酸 | |
| C. | d的原子半径比c的原子半径大 | |
| D. | b的气态氢化物比c的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
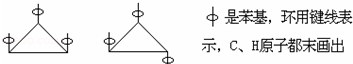
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 油酸和水、甲苯和水、己烷和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
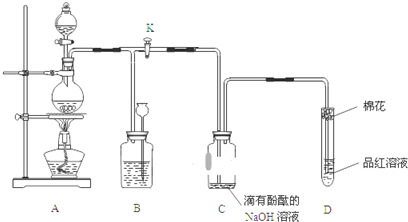
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com