
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJmol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
【答案】 CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-764.7 kJ/mol E1-E2 -285.9 kJ/mol +1275.6kJmol﹣1 O2+4H++4e-=2H2O 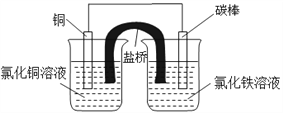
【解析】分析:(1)根据盖斯定律书写;
(2)根据ΔH=E生成物-E反应物计算;
(3)在一定条件下,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量是燃烧热,据此判断;
(4)根据盖斯定律书写;
(5)根据原电池中正极发生得到电子的还原反应分析;
(6)该反应中,Cu失去电子,作负极,铁离子得到电子,在正极放电,以此解答该题。详解:(1)已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
则根据盖斯定律可知①+②即得到甲醇蒸气完全燃烧的热化学反应方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-764.7 kJ/mol。
(2)ΔH=E生成物-E反应物,则根据图像中的能量变化关系图可知ΔH2=(E1-E2)kJ/mol。
(3)根据2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol可知H2(g)的燃烧热为-285.9 kJ/mol。
(4)已知:
①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566kJmol﹣1
则根据盖斯定律可知-(②+①×2)即得到反应2CO2(g)+4H2O(g)=2CH3OH(l)+3O2(g)的△H=+1275.6kJmol﹣1;
(5)氧气在正极通入,得到电子,由于电解质溶液显酸性,则其正极反应可表示为O2+4H++4e-=2H2O;
(6)该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,比Cu不活泼的金属或导电的非金属作正极,氧化反应的烧杯中选择氯化铜为电解质,还原反应中选择FeCl3溶液为电解质溶液,装置图为 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)利用反应![]() 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
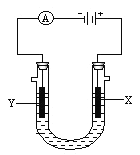
(1)X的电极名称是__________极,发生的电极反应为____________________________;
(2)Y极的电极材料是_________,检验X极产物的方法是_________________________。
(3)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是__________(填化学式),其形成原因是_______________________________________,该沉淀在空气中放置,现象是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol OH-中含有9NA个电子
B. 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+
C. 28 gCO气体中含有NA个氧原子
D. 常温常压下11.2 L甲烷气体含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 核酸中的N存在于碱基中,蛋白质中的N存在氨基中
B. Na、Fe元素既不属于大量元素也不属于微量元素
C. 在细胞中,C元素的含量最多,是构成细胞的最基本元素
D. 等质量的脂肪中C、H的含量较糖类高,故彻底氧化分解产生能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( ) 
A.H2A的电离方程式为H2AH++HA﹣、HA﹣H++A2﹣
B.pH=4的NaHA水溶液中:c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)>c(OH﹣)
C.含NaHA,NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2﹣)+c(HB﹣)+c(H2B)+c(B2﹣)
D.NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB﹣)>c(OH﹣)>c(H+)>c(B2﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com