
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的作用之一是使CO与NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式: 。
(2) 经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:①NO2 NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为 ,NO2在其中起了 作用。
NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为 ,NO2在其中起了 作用。
(1) 2CO + 2NO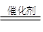 2CO2 + N2 (2) 2O2 = O3 + O ; 催化剂
2CO2 + N2 (2) 2O2 = O3 + O ; 催化剂
解析试题分析:(1)CO与NO反应,生成两种无毒气体,所以根据原子守恒可知,生成物应该是氮气和CO2,因此CO与NO反应的化学方程式2CO + 2NO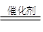 2CO2 + N2。
2CO2 + N2。
(2)将3个反应式合并即得到总反应式2O2= O3 + O,所以NO2起到催化剂的作用。
考点:考查汽车尾气治理以及臭氧形成的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力,也有助于培养学生的环境保护意识。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高二下学期期中考试化学文科试卷(解析版) 题型:填空题
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的作用之一是使CO与NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式: 。
(2)
经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:①NO2 NO+O、②2NO+O2= 2NO2、③O2+O
= O3。则总反应可表示为 ,NO2在其中起了 作用。
NO+O、②2NO+O2= 2NO2、③O2+O
= O3。则总反应可表示为 ,NO2在其中起了 作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com