
 2SO3(g)
2SO3(g) 2SO3(g),化学平衡状态的标志为__________。
2SO3(g),化学平衡状态的标志为__________。| A.SO2减少的化学反应速率和SO3减少的化学反应速率相等 |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的分子总数不随时间而变化 |
| D.恒容的容器中气体的密度不随时间而变化 |
 2SO3(g)
2SO3(g) 2SO3(g)
2SO3(g)

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:不详 题型:实验题
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 的影响;实验①和③探究 的影响。 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始反应时,正反应速率最大 |
| B.随着反应的进行,正反应速率逐渐减小,最后正反应速率减小为零 |
| C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定 |
| D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始反应时,正反应速率最大,逆反应速率为零 |
| B.随着反应的进行,正反应速率逐渐减小,最后减小为零 |
| C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定 |
| D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。
3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g) 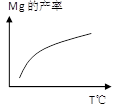
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com