
【题目】Ⅰ.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当丙池中F极质量增加3.2 g时,回答下列问题。
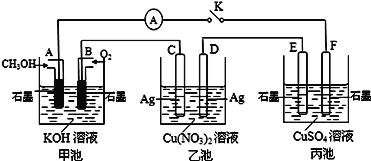
(1)甲、乙分别是什么装置________________、__________________。
(2)写出A电极的电极反应式: _______________________________,丙池总反应的离子方程式__________________________________。
(3)甲池中B电极理论上消耗O2的体积(标准状况下)___________mL。乙池中Cu(NO3)2溶液的浓度____________________(填“变大”、“变小”或“不变”)。
(4)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为_________________。
Ⅱ.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
(1)电池正极发生的电极反应式为__________________________________________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________________。
(3)组装该电池必须在无水、无氧的条件下进行,原因是_________________________。
【答案】 原电池 电解池 CH3OH-6e-+8OH-=CO32-+6H2O 2Cu2++2H2O ![]() 2Cu + 4H+ + O2↑ 560 变小 1 2SOCl2+4e-===4Cl-+S+SO2↑ SOCl2+ H2O===SO2 ↑+ 2HCl↑ 构成电池的主要成分Li能和氧气、水反应,SOCl2也与水反应
2Cu + 4H+ + O2↑ 560 变小 1 2SOCl2+4e-===4Cl-+S+SO2↑ SOCl2+ H2O===SO2 ↑+ 2HCl↑ 构成电池的主要成分Li能和氧气、水反应,SOCl2也与水反应
【解析】Ⅰ.(1)根据装置图可判断甲池为甲醇燃料电池,作为原电池供电,乙池、丙池为串联的两个电解池。(2)A是燃烧电池的负极,甲醇失去电子,发生氧化反应,A电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。D、F是电解池的阴极,C、E是阳极。丙池为惰性电极电解硫酸铜,电解总反应的离子方程式为:2Cu2++2H2O![]() 2Cu + 4H+ + O2↑。(3)丙池中F极析出铜的物质的量为3.2g÷64g/mol=0.05mol。则电路中转移的电子为0.05mol×2=0.1mol,消耗氧气的物质的量是0.1mol÷4=0.025mol,在标准状况下的体积为0.0254mol×22.4L/mol=0.56L,即560mL。乙池中阴极上铜离子放电导致溶液中Cu(NO3)2溶液的浓度变小。(4)电路中转移电子为0.1mol,依据电子得失守恒可知丙池中阳极有0.1mol水电离的氢氧根离子放电生成氧气和0.1mol氢离子,则氢离子浓度是0.1mol/L,所以溶液的pH=1。
2Cu + 4H+ + O2↑。(3)丙池中F极析出铜的物质的量为3.2g÷64g/mol=0.05mol。则电路中转移的电子为0.05mol×2=0.1mol,消耗氧气的物质的量是0.1mol÷4=0.025mol,在标准状况下的体积为0.0254mol×22.4L/mol=0.56L,即560mL。乙池中阴极上铜离子放电导致溶液中Cu(NO3)2溶液的浓度变小。(4)电路中转移电子为0.1mol,依据电子得失守恒可知丙池中阳极有0.1mol水电离的氢氧根离子放电生成氧气和0.1mol氢离子,则氢离子浓度是0.1mol/L,所以溶液的pH=1。
Ⅱ.(1)分析反应的化合价变化可判断Li为还原剂,SOCl2为氧化剂。Li是负极,则正极反应式可由总反应式减去负极反应式得到,即为2SOCl2+4e-===4Cl-+S+SO2↑。(2)根据碱液吸收时的产物可知没有碱液而用水吸收时的产物应为SO2和HCl,所以反应的方程式为SOCl2+H2O===SO2↑+2HCl↑。(3)因为构成电池的主要成分Li能和氧气、水反应,SOCl2也与水反应,所以组装该电池必须在无水、无氧的条件下进行。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
A.NF3是共价化合物B.NF3的还原性比NH3强
C.NF3的氧化性比F2强D.NF3中的N呈+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2催化KClO3分解制取氧气,实验后要分离提纯回收其中的MnO2进行的操作为( )
A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥
C. 溶解、过滤、结晶 D. 溶解、结晶、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.HClO溶于水能电离,破坏了H—O键和O—Cl键
B.CaCl2晶体中存在共价键
C.SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D.NH4Cl受热分解既破坏了离子键,也破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.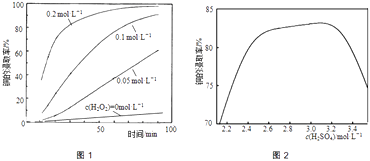
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 .
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2﹣HCl﹣NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 .
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3molL﹣1盐酸、0.5molL﹣1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0molL﹣1时,也有少量的铜被浸出,其原因是 .
③用H2O2﹣HCl﹣NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu2Cu+
(Ⅲ) Cu++nCl﹣CuCln(n﹣1)﹣
(Ⅳ) 2CuCln(n﹣1)﹣+2H++H2O2=2Cu2++2H2O+2nCl﹣
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是(填序号).
a.Na+ b.Cu2+ c.Cl﹣d.OH﹣
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl﹣H2O2混合溶液浸取.
①Cu2S被HCl﹣H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 .
②若由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com