
| 电解 |
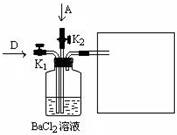
| 电解 |
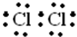
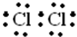
| 1g |
| 2g/mol |

| 12g |
| 120g/mol |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
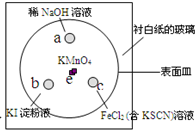 (2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 已知 | 类比推理 |
| A | Na与O2共热生成Na2O2 | H2与O2共热生成H2O2 |
| B | S、Se属于VIA族元素 | Se的氧化物类似S有SeO2、SeO3 |
| C | 常温下,浓硝酸使铁钝化 | 浓硝酸与铜不反应 |
| D | NaOH溶液能溶解Al(OH)3 | 过量NH3?H2O缓慢溶解Al(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com