
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
科目:高中化学 来源: 题型:
【题目】三氯甲醛(CCl3CHO)可用于生产氯霉素、合霉素等,其在实验室制备的反应原理为C2H5OH+4C12![]() CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl
CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl ![]() C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
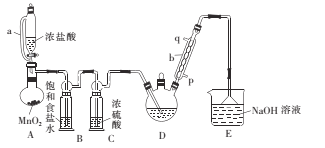
(1)仪器a的名称是____ ,采用该仪器的理由是____
(2)仪器b中冷凝水从___ (填“p”或“q”)口进。
(3)装置A中MnO2用KClO3代替,反应在常温下进行,试写出反应的离子方程式:____。若撤去装置B,对实验的影响是_______ 。
(4)测定产品纯度:
①称取0. 40 g产品,配成待测溶液,加入20. 00 mL0.100 mol/L碘标准溶液,再加适量碱液,充分反应:![]()
②再加适量盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定到终点,发生反应:I2+![]() ;
;
③重复上述操作3次,平均消耗Na2S2O3溶液20. 00 mL。
滴定时所用指示剂是____,达到滴定终点的现象是 ___,测得产品的纯度是____(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1的平衡常数为K1;
反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2的平衡常数为K2。
反应③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
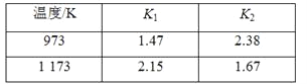
A.K3=K1-K2
B.K3=K1+K2
C.ΔH3>0
D.ΔH3<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O2![]() 2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
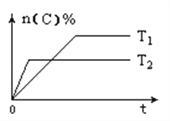

A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
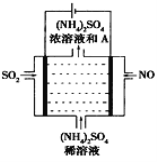
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)写出下列元素的名称 X_______,Y________,Z__________
(2)X—H键和Y—H键属于极性共价键,其中极性较强的是________(X、Y用元素符号表示)键。X的第一电离能比Y的________(填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
(4)W的基态原子的价电子排布式为____________;
(5)Y元素的核外电子轨道表示式为___________。
(6)已知一种Y4分子结构如图所示:

断裂1 mol Y—Y键吸收167 kJ的热量,生成1 mol Y≡Y放出942 kJ热量。则由1molY4气态分子变成2molY2气态分子_______(填写吸收或放出)_______kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系:

(1)元素A在周期表中的位置为________________________。
(2)用电子式表示D2G的形式过程:_________________________________________________,其所含化学键类型为__________。
(3)C2-、D+、G2-半径由大到小的顺序是________(填离子符号)。
(4)C、G的简单氢化物中,沸点较低的是________(填化学式),原因是________________。两种气态氢化物的稳定性C________G(填“>”或“<”)。
(5)C与D形成的具有强氧化性、可以做供氧剂的化合物的电子式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备少量乙酸乙酯的装置如图所示。下列有关该实验说法正确的是
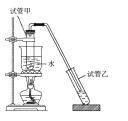
A.乙酸乙酯的沸点小于100℃
B.反应前,试管甲中先加入浓硫酸,后加入适量冰酸醋和乙醇
C.试管乙中应盛放NaOH浓溶液
D.实验结束后,将试管乙中混合液进行蒸发结晶可得到乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com