
分析 (1)配合物中中心原子提供空轨道,配体提供孤电子对;配位键由提供孤电子对的原子指向提供空轨道的原子;
(2)先计算其价层电子对,再根据VSEPR模型分子或离子构型;
(3)由第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,通过sp3杂化形成中性分子,如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对.
解答 解:(1)在配合物Ni(CO)4中,Ni提供空轨道,CO提供孤电子对,故提供空轨道接受孤对电子的微粒是Ni;在配合物[Cu(NH3)4]2+中,铜离子提供空轨道,氮原子提供孤电子对,故提供空轨道接受孤对电子的微粒是Cu2+;在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子,
故答案为:Ni、Cu2+、Fe3+;
(2)H3O+中氧原子含有3个共价单键和一个孤电子对,所以H3O+的分子立体结构为三角锥型,氯化硼中硼原子含有3个共价单键且不含孤电子对,所以BCl3的构型为正三角形;
故答案为:三角锥型,正三角形;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,BF3中心原子B原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{3-3}{2}$=3,sp2杂化是平面形分子,
第二周期元素为中心原子,通过sp3杂化形成中性分子,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,NF3中心原子N原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3}{2}$=4,sp3杂化含有一个孤电子对,是三角锥形分子,
故答案为:BF3、NF3.
点评 本题考查了配合物的成键、分子或离子空间构型的判断、杂化方式的判断等知识点,根据价层电子对互斥理论来分析即可,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 蒸馏、制乙烯时均需在反应器中加入少量碎瓷片 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 燃着的酒精灯打翻起火,应用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
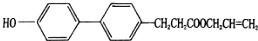
| A. | 能发生加成、加聚、水解和氧化反应 | |
| B. | 分子式为C18H20O3 | |
| C. | 该化合物最多有12个碳原子共平面 | |
| D. | 一定条件下1molR最多可以消耗2molNaoH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液:Fe3+、K+、Cl-、CO32- | |
| B. | c(NH4+)=0.1mol•L-1的(NH4)2Fe(SO4)2溶液:H+、Al3+、Br-、I- | |
| C. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}^{+})}$值明显增大的溶液:K+、NH4+、CO32-、MnO4- | |
| D. | 通入SO2的饱和溶液:Ca2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
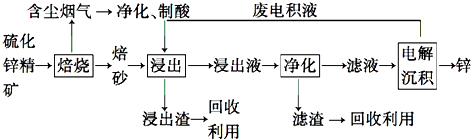
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (M+3N)mol | B. | ($\frac{M}{2}$+3N)mol | C. | ($\frac{M}{2}$+3N+$\frac{7}{2}$W)mol | D. | ($\frac{M}{2}$+3N-$\frac{7}{2}$W)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Q | R | ||
| T | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com