
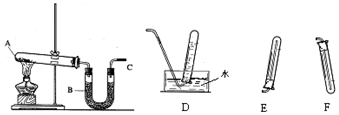
分析 (1)加热氯化铵与氢氧化钙固体反应生成氯化钙、氨气和水;
(2)氨气极易溶于水,比空气轻,不能用排水法收集,可以用向下排空气方法收集;
(3)生成的氨气是碱性气体,含有的水蒸气用碱石灰干燥;
(4)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝,或与氯化氢反应生成白烟检验是否集满;
(5)一氧化氮是比空气略重的气体,难溶于水,易被空气氧化为二氧化氮,依据一氧化氮性质分析判断气体的收集装置.
解答 解:(1)铵盐和碱加热生成氨气,氯化铵和氢氧化钙固体加热,生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,比空气轻,不能用排水法收集,可以用向下排空气方法收集,选择装置E收集;
故答案为:E;
(3)实验生成的氨气是碱性气体,含有的水蒸气用碱石灰干燥;
故答案为:碱石灰;
(4)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝证明集满或蘸有浓盐酸的玻璃棒,冒白烟,
故答案为:用玻璃棒蘸湿润的红色石蕊试纸靠近试管口,若试纸变蓝则已集满或蘸有浓盐酸的玻璃棒,冒白烟;
(5)一氧化氮是比空气略重的气体,难溶于水,易被空气氧化为二氧化氮,所以用排水方法收集纯净的一氧化氮气体,所以选择D装置;
故答案为:D.
点评 本题考查了实验室制备氨气的原理,氨气的性质分析判断,注意氨气极易溶于水生成弱碱一水合氨,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 二氧化碳的水溶液能够导电,故二氧化碳属于电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氧化钠在水中的电离方程式可表示为Na2O=2Na++O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
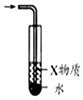
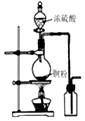
| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
 |  |  | 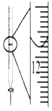 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将酸溅到眼中,应立即用烧碱溶液冲洗,边洗边眨眼睛 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硫酸 | |
| D. | 配制稀硫酸,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
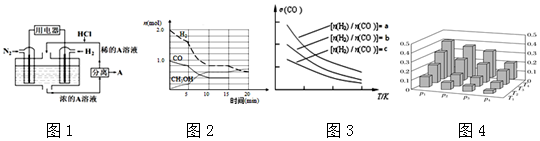
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
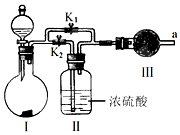
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C12按体积比1:3混合可制得纯净的CHCl3 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| C. | C3H6O2有3种同分异构体,它们均能与钠反应放出氢气 | |
| D. | 人体内的蛋白质分解,最终生成二氧化碳和水排出体外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com