
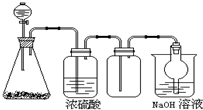
 如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和浓H2SO4 | ||
| C. | 铁片和浓盐酸 | D. | 电石和水 |
分析 由装置图可以看出,在不加热的条件下制备气体,属于固体和液体反应生成气体的发生装置,生成的气体可用浓硫酸干燥,且能用向上排空法收集,说明气体的密度比空气大,和浓硫酸不发生酸反应,用氢氧化钠溶液处理尾气,说明气体为大气污染物,可以和氢氧化钠溶液发生反应.
解答 解:A、二氧化锰和浓盐酸反应生成氯气,氯气有毒,应有氢氧化钠溶液吸收尾气,但反应需要加热才能进行,故A不选;
B、Na2SO3(s)和浓硫酸不加热制取二氧化硫,二氧化硫能用浓硫酸干燥,需要尾气吸收,故B选;
C、铁和浓盐酸反应生成氢气和氯化亚铁,氢气收集是用向下排气法,用氢氧化钠溶液不能吸收尾气,故C不选;
D、电石和水反应生成乙炔,具有还原性,不能用浓硫酸干燥,故D不选;
故选B.
点评 本题考查气体的制备装置,题目难度不大,根据气体制备、干燥、收集,明确气体的性质是解答该题的关键,做题时一定要仔细观察实验装置.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | HCO3- | C. | Fe3+ | D. | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、Na+、ClO、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Mg2+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
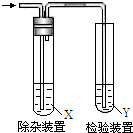 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )| 小组 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,v正=v逆=0 | |
| B. | 化学反应速率关系是2v(NH3)=3v(H2O) | |
| C. | 达到化学平衡时,O2的浓度不再改变 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ④和②混合溶液中:c(H+)=c(OH-) | |
| B. | ①与④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(H+)>c(OH-) | |
| D. | 四种溶液稀释100倍,溶液pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com