
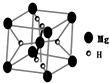
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.分析 (1)①Ti为22号元素,核外电子排布式为1s22s22p63s23p63d24s2;
②计算B原子孤电子对数、价层电子对确定空间构型与B原子杂化方式;LiBH4中,Li+和BH4-形成离子键,BH4-中B原子与H原子之间形成4个共价键,由于B原子最外层有3个电子,故还有1个配位键;
③BH4-中H表现-1价,H元素对键合电子吸引力更大,同周期自左而右电负性增大;
(2)根据均摊法计算晶胞中H、Mg原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度;
MgH2遇水会缓慢反应,实质属于水解反应,生成氢氧化镁与氢气;
(3)根据均摊法计算晶胞中Cu、Au原子数目,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-),氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,可以计算晶胞中H原子数目,进而确定化学式.
解答 解:(1)①Ti为22号元素,核外电子排布式为1s22s22p63s23p63d24s2,外围电子排布式为:3d24s2,
故答案为:3d24s2;
②BH4-中B原子价层电子数=4+$\frac{3+1-1×4}{2}$=4,且不含孤电子对,为正四面体结构,B原子采取sp3杂化,
LiBH4中,Li+和BH4-形成离子键,BH4-中B原子与H原子之间形成4个共价键,由于B原子最外层有3个电子,故还有1个配位键,不含金属键,
故答案为:正四面体;sp3;c;
③BH4-中H表现-1价,H元素对键合电子吸引力更大,同周期自左而右电负性增大,故电负性:H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中镁原子个数=1+8×$\frac{1}{8}$=2,氢原子个数=4×$\frac{1}{2}$+2=4,晶胞质量为$\frac{24×2+4}{{N}_{A}}$g,晶胞的体积为V cm3,则该晶体的密度为$\frac{24×2+4}{{N}_{A}}$g÷V cm3=$\frac{52}{V×{N}_{A}}$g•cm-3,
MgH2遇水会缓慢反应,实质属于水解反应,生成氢氧化镁与氢气,反应方程式为:MgH2+2H2O=Mg(OH)2+2H2↑,
故答案为:$\frac{52}{V×{N}_{A}}$;MgH2+2H2O=Mg(OH)2+2H2↑;
(3)该晶胞中Au原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-,氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,所以该晶胞中应含有8个H,该晶体储氢后的化学式为Cu3 AuH8,
故答案为:Cu3 AuH8.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式与空间结构判断、电负性、晶胞计算等,(1)注意根据BH4-电荷判断元素表现的化合价,进而判断H、B的电负性,注意识记中学常见晶胞结构.


科目:高中化学 来源: 题型:选择题
| A. | 向上述NaOH溶液中通入SO2:2OH-+SO2═SO32-+H2O | |
| B. | 上述反应后所得溶液的PH约为12:SO32-+H2O?HSO3-+OH- | |
| C. | 向上述反应后所得溶液中通入氯气,PH下降:SO32-+Cl2+2OH-═SO42-+2Cl-+H2O | |
| D. | 向上述反应后所得溶液中滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO32-+Ba2++H2O2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
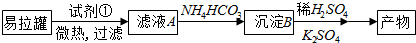
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | Z、W均可与Mg形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
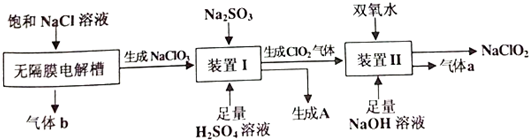
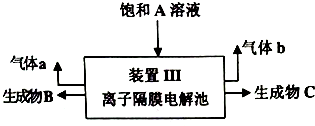

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: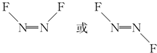 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
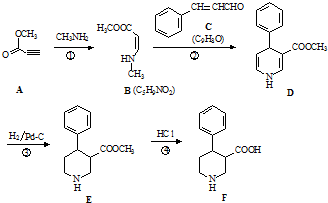
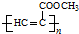 .
.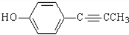 .
.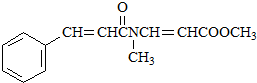 .
.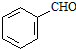 、CH3CH2OH和
、CH3CH2OH和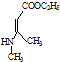 为原料,合成
为原料,合成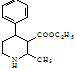 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).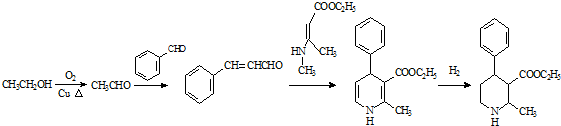
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com