
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
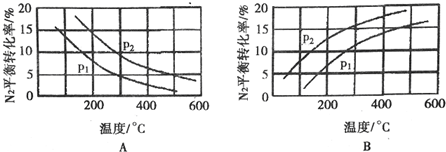
分析 Ⅰ.(1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
Ⅱ.(3)①设平衡时有x molN2转化,计算出转化的氮气的物质的量,再计算出氮气的转化率;
②利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})•{P}^{3}({H}_{2})}$.
解答 解:Ⅰ.(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,
故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大,р2>р1,
故答案为:A;р2>р1;
Ⅱ. (3)①设平衡时有x molN2转化,
N2(g)+3H2(g)?2NH3(g)
起始物质的量:1mol 3mol 0
变化的物质的量:x 3x 2x
平衡物质的量:1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,
解得x=0.6mol,α1 =$\frac{3×0.6}{3}$×100%=60%,
故答案为:60%;
②平衡时各物质的压强之比等于其物质的量之比,所以P(N2)=$\frac{(1-0.6)mol}{2.8mol}$×8MPa=$\frac{8}{7}$MPa,
P(H2)=$\frac{3×(1-0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,P(NH3)=$\frac{(2×0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,
化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})•{P}^{3}({H}_{2})}$=$\frac{(\frac{24}{7})^{2}}{\frac{8}{7}×(\frac{24}{7})^{3}}$≈0.26,
故答案为:0.26.
点评 本题考查了化学平衡计算、影响化学平衡的因素等,题目难度中等,侧重于考查学生分析判断及计算能力,注意三段式在化学平衡计算中的灵活应用,难点是用平衡分压代替平衡浓度计算.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离度 | B. | c(H+) | C. | 电离平衡常数K碱 | D. | c(NH4+) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组拟用下图装置测定某粗锌样品中锌的质量分数。他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应。请填写以下实验报告。
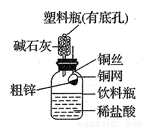
(1)实验目的: 。
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为 。
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为 。
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将 (填“偏大”、“偏小”或“无影响”);
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 实验室金属钠着火,立即用水浇灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com