

| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-40℃NH4F-100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 | 33.3 | 37.2 | 41.4 |


科目:高中化学 来源: 题型:
| A、放热反应都能自发进行,吸热反应都不能自发进行 |
| B、自发反应的熵一定增大,非自发反应的熵一定减小 |
| C、能自发进行的反应一定能实际发生 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L O2含有的分子数为NA |
| B、常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA |
| C、将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol?L-1 |
| D、标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Bi元素的质量数是209.0 |
| B、Bi元素中子数为83 |
| C、Bi原子6p亚层有有一个未成对电子 |
| D、Bi位于第六周期VA族,属于p区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 碱性氧化物 | 酸性氧化物 | 强电解质 | |
| A | 漂白粉 | SiO2 | CO2 | AlCl3溶液 |
| B | CuSO4?5H2O | Na2O2 | N2O5 | NH4NO3 |
| C | 福尔马林 | CaO | Mn2O7 | HClO |
| D | 冰醋酸 | Na2O | SO2 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
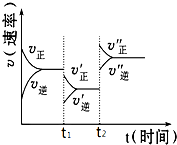 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 金属质量/g | 金属 状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消 失的时 间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
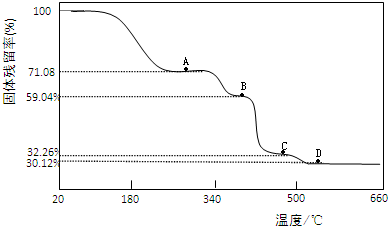
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com