
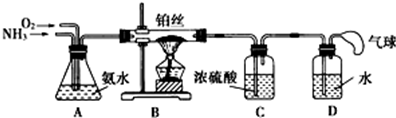
分析 (1)氯化铵加热生成氨气和氯化氢,氯化氢和氨气反应生成氯化铵;氨气易溶于水,稀氨水浓度小,不能制氨气;氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;实验室用固态氯化铵与氢氧化钙混合加热制备氨气和碱石灰中滴加浓氨水方法制氨气;
(2)氨催化氧化生成一氧化氮和水;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮.
解答 解:(1)①固态氯化铵与熟石灰混合加热,是实验室制氨气的主要方法,故①正确;
②固态氯化铵加热分解,成氨气和氯化氢,氯化氢和氨气反应生成氯化铵,故②错误;
③碱石灰中滴加浓氨水,也是实验室制氨气的方法之一,故③正确;
④氯化铵溶液与氢氧化钠溶液共热,氨气易溶于水,能制得氨气但量少,不适合实验室制备氨气,故④错误;
故选:①③;
(2)氨催化氧化生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O
及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,
故答案为:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO.
点评 本题是实验室氨气的制备装置和性质检验,掌握氨气的制备和性质以及掌握氨的催化氧化反应和一氧化氮转化为硝酸的原理是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
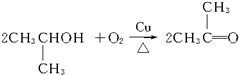 +2H2O)(只写一个)
+2H2O)(只写一个)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com