
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
【答案】D
【解析】
根据图像可知产生CO2消耗盐酸的体积是25mL,而之前消耗盐酸是50mL。由于碳酸钠与盐酸反应时首先转化为碳酸氢钠,然后碳酸氢钠再与盐酸反应放出CO2,方程式为CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑。根据方程式可判断溶液中还含有氢氧化钠,即前25mL盐酸中和氢氧化钠,后25mL盐酸与碳酸钠反应,最后25mL盐酸与碳酸氢钠反应。
A.根据以上分析可知OA段所发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-,A正确;
B.根据以上分析可知NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1,B正确;
C.产生的CO2消耗的盐酸物质的量是0.025L×0.1mol/L=0.0025mol,则根据方程式HCO3-+H+=H2O+CO2↑可知放出CO2是0.0025mol,在标准状况下的体积为0.0025mol×22.4L/mol=0.056 L,C正确;
D.反应结束后溶液中氯化钠的物质的量是0.075L×0.1mol/L=0.0075mol,根据钠离子守恒可知原NaOH溶液的物质的量浓度为0.0075mol÷0.01L=0.75 mol·L-1,D错误;
答案选D。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
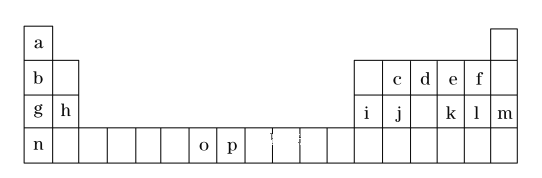
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
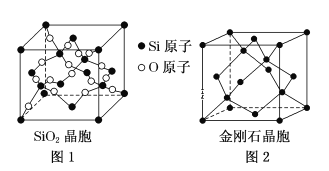
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从矿物学资料查得,一定条件下FeS2(二硫化亚铁)存在反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2参加反应,有10 mol电子转移
C.FeS2只作还原剂
D.产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)配平化学方程式。__FeCl3+__SO2+__H2O=__FeCl2+__H2SO4+__HCl。
(2)除去括号中的杂质,写出除杂反应的离子方程式
①Na2SO4溶液(Na2CO3):_______________________________________________。
②Ca(NO3)2溶液(CaCl2):_______________________________________________。
(3)写出下列反应的离子方程式:
①向烧碱溶液中通入少量CO2气体:_______________________________________________。
②向澄清石灰水中滴加足量的碳酸氢钠溶液:_______________________________________________。
(4)实验室中,制取Fe(OH)3胶体的离子方程式是_______________________________________________,
证明胶体已经制成的方法是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
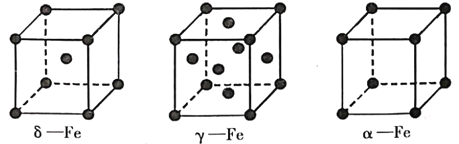
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com