
�����±����ݣ�����ѡ����ȷ����
��ѧʽ | CH3COOH | H2SO3 | NH3��H2O |
���볣��K��25�棩 | Ka=1.8��10��5 | Ka1=1.23��10��2��Ka2=6.6��10��8 | Kb=1.8��10��5 |
A��Na2SO3��Һ�еμ��������ᣬ��Ӧ�����ӷ���ʽΪ��SO32��+2CH3COOH=SO2��+H2O+2CH3COO��
B��25��ʱ��pH=3�Ĵ����pH=11�İ�ˮ�������Ϻ��Һ��ˮ�ĵ��뱻�ٽ�
C��NaHSO3��Һ�����ԣ�����ΪKw/Ka1��K a2
a2
D��0.1mol/L��CH3COOH��Һ���Ũ�ȵ������CH3COONa��Ϻ���Һ�е����������¹�ϵ��
c��H+��+c��CH3COOH��=c��CH3COO����+ c��OH����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶������л�ѧ���������棩 ���ͣ�ʵ����
ʵ�������÷�ӦTiO2��s��+CCl4��g��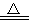 TiCl4��g��+CO2��g��������ˮ�����������Ʊ�TiCl4��ʵ��װ��ʾ��ͼ���£�
TiCl4��g��+CO2��g��������ˮ�����������Ʊ�TiCl4��ʵ��װ��ʾ��ͼ���£�
�й������������±���
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | ��23 | 76 | ��TiCl4���� |
TiCl4 | ��25 | 136 | ����ʪ������������ |
��1������A�������� ��װ��E�е��Լ��� ����Ӧ��ʼǰ���ν������²�������װ������ ����װҩƷ��ͨN2һ��ʱ����ȼ�ƾ��ơ�
��2����Ӧ������IJ���������aֹͣͨN2��bϨ��ƾ��ƣ�c��ȴ�����¡���ȷ��˳��Ϊ ������ţ���ѡ������˳��������� �� ������D�е�Һ̬���������ò����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ����ݹ�����Ϫ�廪��ѧ��һ���¿�һ��ѧ���������棩 ���ͣ������
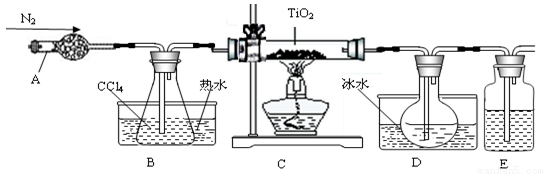
�Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʡ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в�����
�ش��������⣺
��1�����з�����Ӧ�Ļ�ѧ����ʽΪ__________��
��2�����м����Լ����Ŀ����__________��
��3��������Ϊ����������������֮һ�ǵõ�KCl���壬��һ������__________��
��4��ijͬѧ��ȡ�ᴿ�IJ�Ʒ0.76g���ܽ������100mL����ƿ�У�ȡ25.00mL��Һ����25.00mLŨ��Ϊ0.1000mol/L����������Һǡ����ȫ��Ӧ����ò�Ʒ�Ĵ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����������ʵ����ѧ���������л�ѧ���������棩 ���ͣ��ƶ���
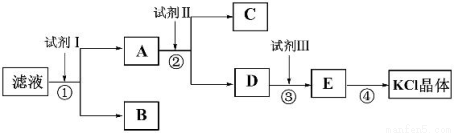
��ͼ�мס���Ϊ���ʣ������Ϊ�����BΪ����Һ̬�����AΪ����ɫ���壬F��G����Ԫ����ͬ�Ҿ�Ϊ�Ȼ��G��KSCN��Һ�Ժ�ɫ��
���ʴ��������⣺
��1����Ӧ��-���У�������������ԭ��Ӧ�����ڻ��Ϸ�Ӧ����______________������ţ���
��2����Ӧ�ݵĻ�ѧ����ʽΪ____________________________��
��3������B��Ӧ�����ӷ���ʽ _______________________________��
��4����ʵ���ҽ�C��Һ����F��Һ�У��۲쵽��������______________________��
��5����F��Һ�м�������ʵ�����A��������Ӧ���ܵ����ӷ���ʽΪ��__________________ ��
��
��6����֪����̪��c��OH���� Ϊ1.0��10��4mol/L��2.5mol/Lʱ�ʺ�ɫ���Ұ�����ڲ���ɫ����3.9g A��50g B��Ϻ����Һ�е���2�η�̪��Һ����Һ���ɫ��Ƭ�̺�ɫ��ȥ�����������Һ���� �����䣩��
�����䣩��
�ټ�ͬѧ��Ϊ����ɫѸ����ȥ����������Һ��c��OH����������ɵģ������۵��Ƿ���ȷ ��
����ͬѧ��Ϊ����ɫѸ����ȥ��������A + B = �� + H2O2 ��H2O2���������Ժ�Ư���Ե��µģ����ʵ��֤����ƿ����Һ�к�H2O2������ʵ�鷽�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����������ʵ����ѧ���������л�ѧ���������棩 ���ͣ�ѡ����
X��Y��Z��W��R��5�ֶ�����Ԫ�أ���ԭ��������������X�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�Yԭ�������������Ǵ�����������3����Z��W��R����ͬһ���ڣ�R��Y����ͬһ�壬Z��Wԭ�ӵĺ��������֮����Y��Rԭ�ӵĺ��������֮����ȡ�����˵����ȷ����
A. Ԫ��X�ֱ���Y��Z��R�����γɶ��ֶ�Ԫ���ۻ�����
B. Ԫ��Y��Z��R�γɵĻ������ˮ��Һ���ܳ����ԡ����Ի�������
C. ���ȶ��ԣ�XmYǿ��XmR���е㣺XmY����XmR
D. ����Ԫ�صĵ����ڳ���������������̬�������ǹ�̬��һ����Һ̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������л�ѧ�Ծ��������棩 ���ͣ������
��ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��á���ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO�������� CH3CN �ȣ��ش��������⣺
��1���Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ�棨 C3H3N���������ϩȩ�� C3H4O�����Ȼ�ѧ����ʽ���£�
��C3H6��g��+NH3��g��+1.5O2��g��=C3H3N��g��+3H2O��g�� ��H=-515kJ��mol��1
��C3H6��g��+O2��g��=C3H4O��g��+H2O��g�� ��H=-353kJ��mol��1
������Ӧ������ѧ�����ƾ��ܴ���ԭ����____________����������߱�ϩ��ƽ����ʵķ�Ӧ������_______________����߱�ϩ�淴Ӧѡ���ԵĹؼ�������___________��
��2��ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460�档����460��ʱ����ϩ��IJ���___________����ǡ����ߡ����ǡ�����Ӧ�¶��µ�ƽ����ʣ��ж�������______________������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����___________��˫ѡ�����ţ���
A���������Խ��� B��ƽ�ⳣ����� C������Ӧ���� D����Ӧ�������
��3����ϩ��ͱ�ϩȩ�IJ����� n������ /n����ϩ���Ĺ�ϵ��ͼ��b��ʾ��
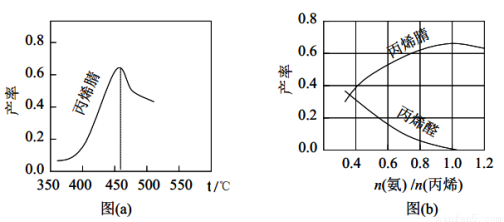
��ͼ��֪����� n������ /n����ϩ��ԼΪ_____________��������______________________�����ϰ�����������ϩ���������ԼΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����1L 3mol�� L-1�����ᡢ1L 3mol�� L-1������������Һ�������������ʣ��������Ʊ��õ��������������ʵ���Ϊ
A��1mol B��3mol C��4mol D��6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����������������и��������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ���ӷ���ʽ����
A���������ƹ�����ˮ��Ӧ��2O22����2H2O ��4OH����O2��
B��������[KAl��SO4��2]��Һ����μ���Ba��OH��2��Һ��SO42��ǡ�ó�����ȫ��
2Al3����3SO42����3Ba2����6OH����2Al��OH��3����3BaSO4��
C�������������Һ��ͨ������SO2��ClO����SO2��H2O��Cl����SO42����2H��
D��FeSO4������Һ��¶�ڿ����У�4Fe2����O2��4H����4Fe3����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ���������л�ѧ���������棩 ���ͣ�ѡ����
NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ�����ͼ��ʾ��������˵����ȷ����
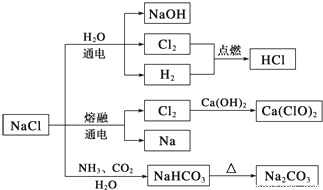
A�����Ȼ����Ʊ�����Ĺ����У������������ܽ�ȵIJ���
B����Cl2�Ʊ�Ư��ʱ���ǽ�Cl2ͨ�����ʯ��ˮ��
C�������¸����Cl2���ø�ƿ���棬����Cl2��������Ӧ
D��ͼʾת����Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com