
分析 依据配制溶液体积及实验室容量瓶规格选择合适的容量瓶;
依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸的体积,依据浓盐酸体积选择量筒规格.
解答 解:用12mol•L-1的浓盐酸配制450mL0.1mol•L-1的稀盐酸,实验室没有450mL容量瓶,依据“大而近”的原则应选择500mL容量瓶,实际配制500mL溶液;
设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×12mol/L=0.1mol/L×500mL;
解得V=4.2mL,应选择10mL量筒;
故答案为:(1)4.2;10mL;(2)500mL.
点评 本题主要考查了一定质量分数的溶液的配制,明确溶液稀释规律及容量瓶、量筒规格选择方法即可解答,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.01 mol/(L•s) | B. | v(C)=0.8 mol/(L•s) | C. | v(C)=0.04 mol/(L•s) | D. | v(C)=0.08 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
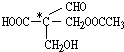 其中带*号的碳原子即是手性碳原子,现欲使该物质因不含手性碳原子而失去光学活性,下列反应中不可能实现的是( )
其中带*号的碳原子即是手性碳原子,现欲使该物质因不含手性碳原子而失去光学活性,下列反应中不可能实现的是( )| A. | 加成反应 | B. | 消去反应 | C. | 水解反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C4H10O3 | B. | C5H12O4 | C. | C4H12O4 | D. | C5H12O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
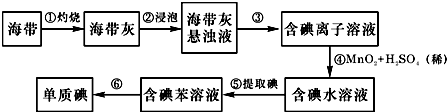
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
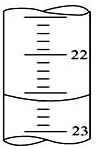 (I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com