
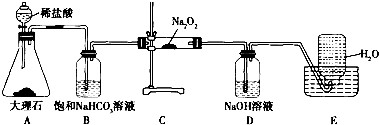
分析 由实验装置可知,A中碳酸钙与盐酸反应生成二氧化碳气体,B中饱和碳酸氢钠溶液除去挥发的HCl,C中过氧化钠与二氧化碳反应生成氧气、过氧化钠与水反应生成氧气,D中NaOH溶液吸收过量的二氧化碳,E装置为排水法收集氧气,以此来解答.
解答 解:由实验装置可知,A中碳酸钙与盐酸反应生成二氧化碳气体,B中饱和碳酸氢钠溶液除去挥发的HCl,C中过氧化钠与二氧化碳反应生成氧气、过氧化钠与水反应生成氧气,D中NaOH溶液吸收过量的二氧化碳,E装置为排水法收集氧气,
(1)由实验装置分析可知B装置的作用为吸收A中挥发出的HCl,故答案为:吸收A中挥发出的HCl;
(2)C装置为02的发生装置,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2CO2═2Na2CO3+O2;2Na2O2+2H2O═4NaOH+O2↑;
(3)D装置可除去C装置中未反应的某气体,反应的离子方程式为2OH-+CO2═CO32-+H2O,
故答案为:2OH-+CO2═CO32-+H2O;
(4)碳酸钠与氯化钡、氯化钙均能反应生成白色沉淀,则C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量CaCl2或BaCl2溶液,若有白色沉淀生成,则证明固体中含有Na2CO3,
故答案为:CaCl2或BaCl2;Na2CO3.
点评 本题考查物质的制备实验和性质实验,为高频考点,把握实验装置的作用、物质的性质和发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
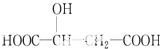
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH-═Na2SiO3+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
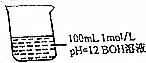 常温下对图中溶液分别进行下列操作,相关分析正确的是( )
常温下对图中溶液分别进行下列操作,相关分析正确的是( )| A. | 稀释10倍,溶液中n(H+)•n(OH-)不变 | |
| B. | 加人100mL pH=2的盐酸,溶液中存在c(Cl-)=c(B+) | |
| C. | 加入少量BCl固体,固体溶解后溶液pH不变(忽略溶液体积变化) | |
| D. | 若升高温度,$\frac{c({B}^{+})+c({H}^{+})}{c(0{H}^{-})}$保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 离子化合物可能含共价键,共价化合物可能含离子键 | |
| C. | 任何单质中一定含共价键 | |
| D. | 离子键的本质就是阴阳离子间的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
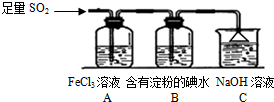 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
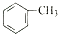 ;b.CH≡CCH3; c、
;b.CH≡CCH3; c、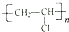
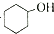 和
和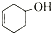 ,可选用b(填字母)
,可选用b(填字母)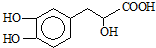
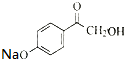
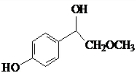
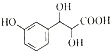 )与足量溴水反应所得产物的结构简式为
)与足量溴水反应所得产物的结构简式为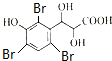 .
.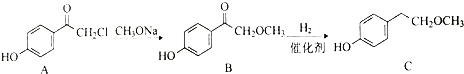
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com