
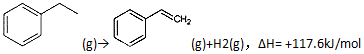
分析 (1)根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;方程式相加时,总平衡常数等于分方程的平衡常数之积;
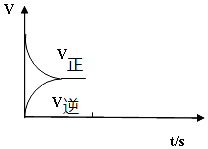
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大.
解答 解:(1)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol
反应②: (g)→
(g)→ (g)+H2(g)△H=+117.6kJ/mol
(g)+H2(g)△H=+117.6kJ/mol
根据盖斯定律:①+②,得CO2(g)+ +CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,
+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,
反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2,
故答案为:CO2(g)+ +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1•K2;
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1•K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,
,
故答案为: .
.
点评 本题考查化学平衡及其影响、盖斯定律的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气、酒精分别属于化石能源、可再生能源 | |
| B. | 金属在潮湿空气中生锈,主要是发生析氢腐蚀 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | 高纯硅广泛应用于太阳能电池和半导体材料的制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
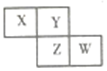 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com