
【题目】下列实验方案能达到目的的是( )
A.除去NaCl溶液中混有的MgCl2:加入适量氨水后过滤
B.提纯混有少量硝酸钾的氯化钠:将混合物溶于热水中,再冷却、结晶并过滤、洗涤、干燥
C.实验室获取少量纯净的水:用蒸馏的方法来蒸馏自来水
D.提取碘水中的碘:可加入适量乙醇,振荡、静置、分液
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是
A. 金属钠和水反应:2Na+2H2O=2Na++2OH-+H2↑
B. 澄清石灰水中通入过量的二氧化碳:CO2+OH-=HCO3-
C. 室温下用稀HNO3溶解铜:Cu+2H++2NO3-=Cu2++2NO2↑+H2O
D. 饱和Na2CO3与CaSO4固体反应:CO32-(aq)+CaSO4(s)=CaCO3(s)+SO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用如图所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
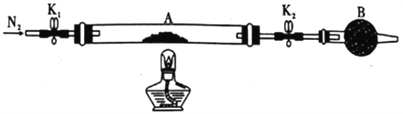
a.打开K1和K2,缓缓通入N2; b.点燃酒精灯加热; c.熄灭酒精灯;d.冷却至室温;e.关闭K1和K2; f.称重A;g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是__________ ,通入N2的目的是___________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。

①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有____________(填化学式)。
②装置F中盛放的物质是___________(填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中A的化学式为________。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为清理高速公路上的积雪使用了一种融雪剂,其主要成分的化学式为XY2 , X原子的结构示意图为 ![]() ,X的阳离子与Y的阴离子的电子层结构相同.元素Z,W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z,W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z,W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z,W能形成一种WZ2型分子.
(1)m= , 该融雪剂的化学式为 .
(2)Z,W元素的名称为、 .
(3)下列说法正确的是 .
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是 .
A.XY2的电子式: ![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为Y2+Z2﹣=2Y﹣+Z↓
D.用电子式表示XY2的形成过程为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达平衡时,X的转化率为50%
B. 反应可表示为:X+3Y![]() 2Z,其平衡常数为1 600
2Z,其平衡常数为1 600
C. 改变压强可以改变此反应的平衡常数
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黄铜矿样品标注显示:主要成分为CuFeS2,其余多为脉石(SiO2)。为检验该黄铜矿中的成份,设计了如下实验:


已知:①在空气存在下煅烧黄铜矿,生成Cu、Fe3O4和SO2气体。
②亚硫酸易被氧化:2H2SO3 + O2 = 2H2SO4
请回答下列问题:
(1)该实验装置组装完成后首先应进行的操作是:__________________。
(2)请指出该装置的一个不足之处:___________________。
(3)请设计一个实验方案,证明C中含有SO2和SO42-___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com