
| A、6.72L NO2与水充分反应转移的电子数目为0.2NA |
| B、12.0g NaHSO4固体中含有的阳离子数为0.2NA |
| C、用含0.01 mol KI的稀溶液制取碘化银胶体时,产生胶体粒子0.01NA个 |
| D、常温下体积相同容器分别装有质量相同的N2、CO气体,产生的压强相同 |
| m |
| M |
| m |
| M |
| 12g |
| 120g/mol |


科目:高中化学 来源: 题型:
| A、2mol FeSO4发生反应时,共有10 mol电子发生转移 |
| B、Na2FeO4既是氧化产物又是还原产物 |
| C、Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水 |
| D、Na2O2在上述反应中只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1(b-2a)mol/L |
| B、10(b-2a)mol/L |
| C、10(2a-b)mol/L |
| D、4(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同位素:1H+、2H+、2H2、2H、3H |
| B、同素异形体:C60、金刚石、石墨 |
C、同分异构体: 和 和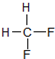 |
| D、同系物:CH2O、C2H4O、C3H6O、C4H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温、常压下,16 g O3中含有的氧原子数为NA |
| B、7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA |
| C、0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA |
| D、标准状况下,11.2 L H2O中含有的氢原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Fe与稀H2SO4反应:Fe+2H+═Fe3++H2↑ |
| B、Al(OH)3治疗胃酸过多:H++OH-═H2O |
| C、NaHCO3溶液与NaOH溶液混合:HCO3-+OH-═H2O+CO2↑ |
| D、Al与NaOH溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com