
| A. | 硬度一定很大 | B. | 熔沸点一定很高 | C. | 一定只含共价键 | D. | 可能含有离子键 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
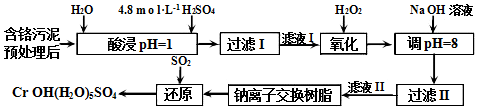
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7gNH4C1中含有的共用电子对数为NA | |
| B. | 0.5mol•L-1CH3COONa溶液中含有CH3COO-的数目少于0.5 NA | |
| C. | 22gN2O和22gCO2所含有的质子数均为11NA | |
| D. | 足量的镁与一定量的浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
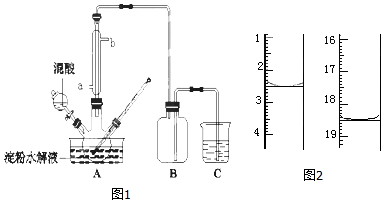
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
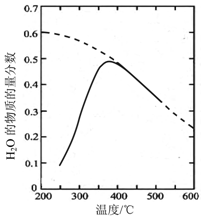 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com