
| A. | 2mol | B. | 4mol | C. | 5mol | D. | 6mol |
分析 乙烯和氯气发生加成反应生成二氯乙烷,1mol双键加成需要1mol的氯气;有机物中的氢原子被氯原子取代时,取代的氢原子的物质的量与氯气的物质的量相等,所以最多消耗的氯气为这两部分之和.
解答 解:解:CH2=CH2+Cl2→CH2ClCH2Cl,所以1mol乙烯与氯气发生加成反应需要氯气1mol;
CH2ClCH2Cl+4Cl2$\stackrel{光照}{→}$CCl3CCl3+4HCl,所以1molCH2ClCH2Cl与氯气发生取代反应,最多需要4mol氯气,这两部分之和为1mol+4mol=5mol.
故选C.
点评 本题考查了取代反应和加成反应,为高频考点,侧重于学生的分析能力和计算能力的考查,明确加成反应和取代反应中各反应物之间物质的量的关系是解本题的关键,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{28}$<M<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<M<$\frac{1}{22.4}$ | C. | $\frac{1}{39.2}$<M<$\frac{1}{28}$ | D. | 0<M<$\frac{1}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种元素的原子量为m | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | (m+n)可写在该元素符号的左上角 | |
| D. | 核内中子的总质量小于质子的总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
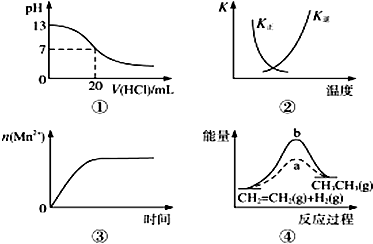
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电力能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | … |
| 电力能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
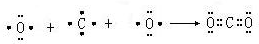
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com