
| A. | a>b>c | B. | b>a>c | C. | c>a>b | D. | c>a>b |
分析 硫酸钠的密度比水大,溶液浓度越大,密度越大,乙醇密度比水小,溶液浓度越大,密度越小;假设两种溶液的质量分数分别是x y,其中x<y,若把题中两种硫酸钠等体积混合想象成熟知的等质量混合(化陌生为熟悉),则混合后溶液中溶质的质量分数为$\frac{x+y}{2}$,硫酸钠越浓,密度越大,故等体积混合时,较浓硫酸钠的质量比混合溶液的质量一半要多,所以混合后溶液中溶质的质量分数应大于$\frac{x+y}{2}$;乙醇的密度比水小,情况和硫酸钠溶液的相反.
解答 解:假设两种溶液的质量分数分别是x y,其中x<y,
对于硫酸钠溶液,
等质量(假设都是m g)混合之后,混合溶液质量分数a%=$\frac{mx+my}{2m}$=$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的硫酸钠的密度比较小,等体积的两种硫酸钠溶液,质量分数大的质量大,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的高质量分数组分的硫酸钠,因此混合溶液质量分数b%>$\frac{x+y}{2}$;
同样,对于乙醇溶液,
等质量混合时其浓度依然是a%=$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的乙醇溶液密度比较大(因为乙醇的密度比水小),等体积的两种乙醇溶液,质量分数大的质量小,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的低质量分数组分的乙醇溶液,因此混合溶液质量分数c%<$\frac{x+y}{2}$,
则有:b>a>c,
故选B.
点评 本题考查了溶质质量分数的计算与判断,题目难度中等,注意掌握溶质质量分数为概念及表达式,明确硫酸钠的浓度越大、密度越大,乙醇的浓度越大、密度越小为解答关键.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 二氯甲烷的分子数约为NA 个 | |
| B. | 常温常压下,2.0 g 重水(D2O)中含NA 个中子 | |
| C. | 1 L 0.1mol•L-1 的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA 个,则阳极质量减少64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钡溶液于稀硫酸反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH -═Cl-+ClO-+H2O | |
| D. | 实验室中氯气的制取:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
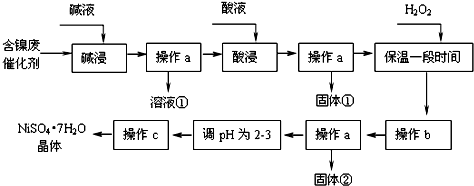
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀pH | 沉淀完全pH | 开始溶解pH | 溶解完全pH |
| Fe(OH)3 | 2.3 | 4.1 | 14 | - |
| Al(OH)3 | 2.3 | 5.2 | 7.8 | 10.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com