
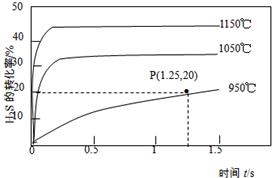
 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
分析 A、图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大;
B、升高温度,硫化氢的转化率变大,说明平衡正向移动;
C、H2的平均反应速率为:v=$\frac{△c}{△t}$;
D、Qc=$\frac{0.0{1}^{2}×0.05}{0.0{4}^{2}}$=3.125×10-4,而反应正向移动,所以平衡常数的值大于3.125×10-4.
解答 解:A、图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大,反应向正反应方向进行,所以v(正)>v(逆),故A错误;
B、升高温度,硫化氢的转化率变大,说明平衡正向移动,正反应方向是吸热反应,故B错误;
C、2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,此时硫化氢的转化率为:20%,则氢气的变化量为:0.1×0.2=0.02mol,所以v(H2)=$\frac{\frac{0.02mol}{2L}}{1.25s}$=0.008mol•L-1•s-1,故C正确;
D、Qc=$\frac{0.0{1}^{2}×0.05}{0.0{4}^{2}}$=3.125×10-4,而反应正向移动,所以平衡常数的值大于3.125×10-4,故D错误;
故选C.
点评 本题考查化学平衡的计算等知识,题目难度中等,注意掌握化学反应速率、明确反应进行的方向,是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
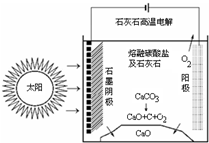 CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
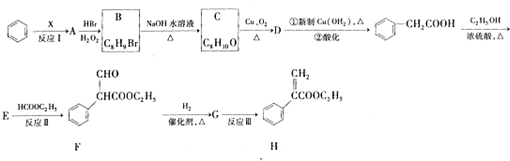
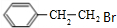 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基. .
. 制备
制备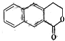 的合成路线
的合成路线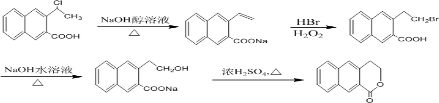 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
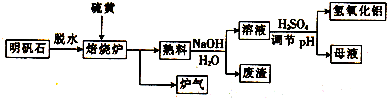
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
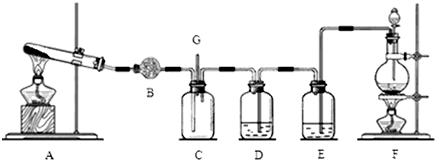
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com